非洲猪瘟是危害世界养猪业的“头号杀手”,然而,非洲猪瘟病毒(ASFV)在猪体内真实生理环境下感染的感染细胞嗜性及致病机制仍不明确。阐明非洲猪瘟病毒在猪体内感染的靶细胞及病毒在靶细胞内延长感染的机制对非洲猪瘟防控具有重要意义。
近日,中国农业科学院兰州兽医研究所郑海学研究员团队解析了非洲猪瘟病毒在猪体内感染的靶细胞,以及在靶细胞内延长感染(Prolonged infection)的机制。相关研究成果发表在《美国科学院院报(PNAS)》上。
非洲猪瘟病毒是一种大型双链DNA病毒,具有极高的稳定性和生存能力。它可以在空气中保持活性数日,在血液、粪便和组织中长期存活,甚至在未熟肉品、腌肉、泔水中也能长时间存活。这种病毒的顽强生命力使得其传播变得极为容易,一旦爆发,往往难以控制。
郑海学研究员团队的研究发现,非洲猪瘟病毒感染后,脾脏成为了病毒载量最高的器官,一类罕见的单核细胞是其延长感染的主要群体。这一发现为我们理解非洲猪瘟病毒的感染路径提供了重要线索。
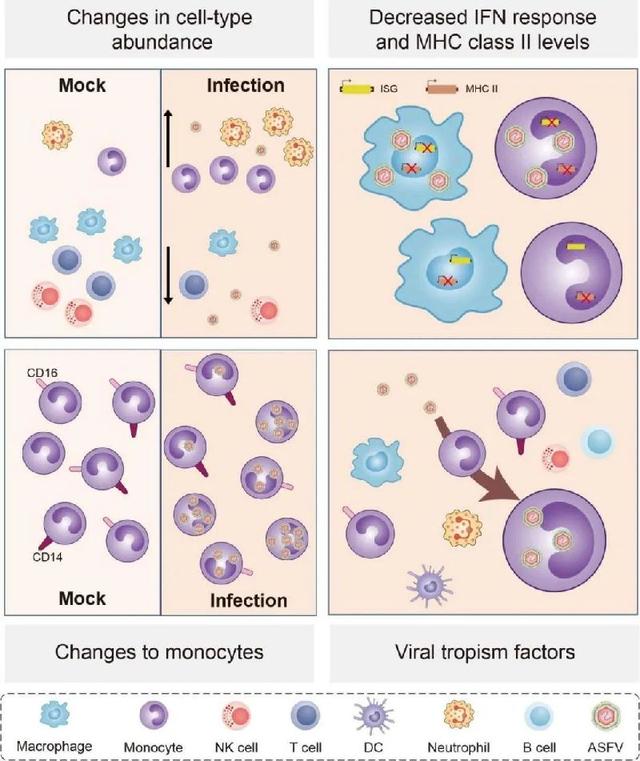
ASFV感染过程中细胞类型和丰度、分子特征,以及脾脏中ASFV的细胞嗜性变化示意图
郑海学介绍,脾脏是猪体内的重要免疫器官,它负责过滤血液中的病原体,并启动免疫反应来对抗感染。然而,非洲猪瘟病毒却巧妙地利用了这一点,将脾脏作为其在猪体内的“大本营”,大量复制并传播病毒。
进一步的研究揭示,巨噬细胞和单核细胞是脾脏中非洲猪瘟病毒感染的主要靶细胞。巨噬细胞是免疫系统中的重要成员,它们负责吞噬并消灭病原体。然而,在非洲猪瘟病毒的攻击下,这些“战士”却纷纷倒下,大量死亡。与此同时,一种罕见的单核细胞亚群成为了病毒感染的主要群体。这些细胞均未表达或低表达单核细胞的标记分子CD14,使得它们能够躲避免疫系统的侦查,成为病毒的“隐身衣”。
更为狡猾的是,非洲猪瘟病毒还通过抑制靶细胞的凋亡、干扰素反应和抗原呈递能力来延长其在猪体内的感染时间。这相当于病毒在猪体内建立了一个“避风港”,使得它们能够安然无恙地复制和传播,而不受免疫系统的干扰。
近日,中国农业科学院兰州兽医研究所郑海学研究员团队解析了非洲猪瘟病毒在猪体内感染的靶细胞,以及在靶细胞内延长感染(Prolonged infection)的机制。相关研究成果发表在《美国科学院院报(PNAS)》上。
非洲猪瘟病毒是一种大型双链DNA病毒,具有极高的稳定性和生存能力。它可以在空气中保持活性数日,在血液、粪便和组织中长期存活,甚至在未熟肉品、腌肉、泔水中也能长时间存活。这种病毒的顽强生命力使得其传播变得极为容易,一旦爆发,往往难以控制。
郑海学研究员团队的研究发现,非洲猪瘟病毒感染后,脾脏成为了病毒载量最高的器官,一类罕见的单核细胞是其延长感染的主要群体。这一发现为我们理解非洲猪瘟病毒的感染路径提供了重要线索。

ASFV感染过程中细胞类型和丰度、分子特征,以及脾脏中ASFV的细胞嗜性变化示意图
郑海学介绍,脾脏是猪体内的重要免疫器官,它负责过滤血液中的病原体,并启动免疫反应来对抗感染。然而,非洲猪瘟病毒却巧妙地利用了这一点,将脾脏作为其在猪体内的“大本营”,大量复制并传播病毒。
进一步的研究揭示,巨噬细胞和单核细胞是脾脏中非洲猪瘟病毒感染的主要靶细胞。巨噬细胞是免疫系统中的重要成员,它们负责吞噬并消灭病原体。然而,在非洲猪瘟病毒的攻击下,这些“战士”却纷纷倒下,大量死亡。与此同时,一种罕见的单核细胞亚群成为了病毒感染的主要群体。这些细胞均未表达或低表达单核细胞的标记分子CD14,使得它们能够躲避免疫系统的侦查,成为病毒的“隐身衣”。
更为狡猾的是,非洲猪瘟病毒还通过抑制靶细胞的凋亡、干扰素反应和抗原呈递能力来延长其在猪体内的感染时间。这相当于病毒在猪体内建立了一个“避风港”,使得它们能够安然无恙地复制和传播,而不受免疫系统的干扰。
 郑海学研究员在生物安全三级实验室(P3)检查免疫保护猪
郑海学研究员在生物安全三级实验室(P3)检查免疫保护猪这项研究系统阐明了非洲猪瘟病毒体内感染的细胞嗜性、病毒复制和感染动态,以及激发免疫反应的特征,为非洲猪瘟病毒感染路径的鉴定和感染致病机制的阐明提供了重要数据。
据悉,郑海学研究员为本文通讯作者,朱紫祥研究员、毛箬青博士和刘保红博士为本文共同第一作者。该研究得到国家重点研发计划、国家自然科学基金、中国农业科学院科技创新工程科学中心重点任务、国家生猪产业体系、甘肃省科技重大专项等项目资助。
















