摘要
小干扰RNA通常通过序列特异性降解mRNA来阻断基因表达。我们此前开发了一种重组腺病毒,该病毒由U6启动子驱动,表达三种靶向口蹄疫病毒(FMDV)的短发夹RNA(Ad-3siRNA)。这些短发夹RNA对FMDV表现出快速的抗病毒作用。在此,我们研究了Ad-3siRNA与口蹄疫灭活疫苗联合使用的免疫刺激效果。通过将Ad-3siRNA与口蹄疫(FMD)灭活疫苗联合使用,我们观察到在接种后1周内保护效力增强,且小鼠从接种后1周开始中和抗体水平升高。此外,接种疫苗和Ad-3siRNA联合制剂的猪,接种后7周内体液免疫显著增强。Ad-3siRNA可诱导小鼠产生多种细胞因子,如IFN-α、IFN-γ、IL-12、IL-6、IL-15和IL-18。总之,我们证明了Ad-3siRNA是一种通过人腺病毒载体递送的新型免疫刺激RNA,与FMD灭活疫苗联合使用时可增强保护作用和体液免疫。Ad-3siRNA在其他病毒性疾病中的应用及进一步的机制研究尚需进一步探索。
1.前言
RNA干扰(RNA interference,RNAi)技术是通过小分子干扰RNA(small interfering RNAs,siRNA)或短发夹RNA(short hairpin RNAs,shRNA)引导的序列特异性mRNA降解来抑制基因表达。已有报道称RNAi应用存在非特异性“脱靶效应”。免疫刺激性siRNA(isiRNA)除了抑制靶标表达外,还能触发先天免疫反应。免疫激活通过视黄酸诱导基因I(RIG-I)、黑色素瘤分化相关蛋白5(MDA-5)、蛋白激酶R(PKR)、toll样受体(TLR)3或TLR7/8发生。最近,有报道称isiRNA具有抗病毒和抗肿瘤潜力。此外,isiRNA作为疫苗佐剂已被研究,可增强体液和细胞免疫。
口蹄疫(FMD)是一种急性传染性疾病,可感染牛、猪、羊和山羊等偶蹄动物。导致其发热,口腔、舌头、乳头和蹄部起水泡。口蹄疫病毒(FMDV)是一种单链正链RNA病毒,属于小RNA病毒科口蹄疫病毒属,有7个血清型和60多个亚型。目前使用灭活疫苗预防FMDV传播,但是,应用过程中应根据血清型和亚型选择不同的疫苗株。此外,使用现有的FMD疫苗形成抗体以控制FMD的爆发是一个漫长的过程。因此,在疫苗诱导的保护性免疫形成之前,可使用抗病毒药物在爆发期间提供快速保护并减少FMDV的传播。最近,我们建议将具有佐剂作用的抗病毒药物与FMD灭活疫苗联合使用,以实现早期保护和增强疫苗免疫。建议的抗病毒药物是长效猪干扰素(IFN)-α和I型IFN诱导剂,如槲皮素。我们观察到I型IFN和IFN诱导剂在体内能有效增强免疫力并抑制FMDV复制。最近,我们建议将具有佐剂作用的抗病毒药物与FMD灭活疫苗联合使用,以实现早期保护和增强疫苗免疫。建议的抗病毒药物为持续时间改善的猪干扰素(IFN)-α和I型IFN诱导剂,如槲皮素。我们观察到I型IFN和IFN诱导剂在体内能有效增强免疫力并抑制FMDV复制。
我们开发了一种重组腺病毒,可同时表达三种靶向FMDV非结构蛋白区域的三种短发夹RNA(shRNA),其中Ad-3siRNA能诱导快速(在感染后6小时内)且有效的FMDV抑制。通过利用5型人腺病毒递送载体,它可直接应用于包括小鼠和猪在内的多种宿主。我们建议通过联合使用siRNA和I型IFN以产生快速起效且持久的保护力从而控制猪群中FMD。然而,我们并不排除Ad-3siRNA作为IFN诱导剂的潜力,因为除了一些isiRNA报道之外,还有关于Ad-3siRNA可刺激猪细胞中的干扰素刺激基因(ISG)的报告。
在此,我们研究了Ad-3siRNA与FMD灭活疫苗联合使用的免疫刺激效果,重点关注猪细胞中I型IFN的产生和ISG的表达,以及Ad-3siRNA与FMD疫苗联合使用在小鼠和猪中诱导的中和抗体滴度。
2.材料和方法
2.1细胞和病毒
人胚胎肾(HEK)293细胞:在含4mM L-谷氨酰胺的293无血清培养基中培养,置于37°C、5%CO₂培养箱中。猪肾(IBRS-2和LFBK)细胞使用添加10%胎牛血清(FBS,pH7.4)的DMEM培养基在37℃、5%CO2培养箱中进行培养。表达5型人腺病毒E1 DNA的HEK293细胞用于扩增重组腺病毒和进行腺病毒滴度测定。IBRS-2细胞用于测试干扰素和ISG诱导。LFBK细胞用于病毒中和试验和FMDV滴度测定。表达多种靶向FMDV的siRNA的重组腺病毒(Ad-3siRNA)和重组腺病毒阴性对照(Ad-null control)由我们实验室建立。三种shRNA靶向FMDV基因组的高度保守的2B和3C区域(图1A)。腺病毒DNA包含三个U6启动子、shRNA编码序列(2B、3C2和3C1 shRNA)以及含六个胸苷的pol III转录终止子(图1B)。韩国FMDV分离株O/SKR/Boeun/2017(GenBank登录号MG983730)用于评估抗病毒效果,FMDV A/SKR/Yeoncheon/2017(GenBank登录号KR766148)用于病毒中和抗体检测。使用Karber法测定和计算病毒滴度(Ramakrishnan,2016)。
图1.Ad-3siRNA示意图。(A)口蹄疫病毒全基因组示意图。黑色箭头表示shRNA的靶区域。(B)Ad-3siRNA的构建。腺病毒DNA含有三个U6启动子、shRNA编码序列(2B、3C 2和3C 1 shRNA)和pol III转录终止子。
2.2 I型干扰素蛋白检测
将IBRS-2细胞(3×10⁵个细胞/孔)接种到24孔板中。次日,用50感染复数(MOI)的Ad-3siRNA或Ad-null control感染细胞,在37°C下孵育。感染后2小时用新鲜培养基更换培养基后,将细胞在37°C下孵育。在8、24和48小时收集上清液,使用猪IFN-α酶联免疫吸附测定(ELISA)试剂盒和猪IFN-βELISA试剂盒测量上清液中的猪IFN-α和IFN-β水平。
2.3干扰素测定
如前所述,通过基于FMDV的IFN测定分析24和48小时收集上清液的抗病毒活性。简而言之,将LFBK细胞在96孔板中培养至90%。然后加入两倍稀释的上清液。24小时后,移除上清液,每孔用250 TCID50的FMDV感染1小时,并在37°C下孵育48小时。在诱导50%细胞病变效应(CPE)抑制的最高稀释度下测量抗FMDV的抗病毒活性(单位)。
2.4动物实验
7周龄雌性C57BL/6小鼠,BALB/c小鼠,FMDV中和抗体阴性(中和抗体滴度<1:8)的9周龄仔猪。
2.4.1小鼠保护作用分析
C57BL/6小鼠(每组5只)在攻毒前1天或7天通过肌内注射FMD疫苗、Ad-3siRNA或Ad-null control的组合(3×10⁸TCID50/dose)或PBS,以评估对FMDV的保护作用。FMD灭活疫苗由A/SKR/Yeoncheon/2017的FMD疫苗抗原(0.25μg/dose)、10%氢氧化铝凝胶和Montanide ISA 206配制而成。通过腹腔注射250LD50的小鼠适应型FMDV A/Malaysia/97攻击小鼠。在攻击后8天内监测小鼠的存活率。
2.4.2小鼠体液免疫测定(短期)
为分析接种后三周的中和抗体水平,使用C57BL/6小鼠(每组5只),通过肌内注射FMD疫苗、Ad-3siRNA或Ad-null control(3×10⁸TCID50/dose)的组合或PBS。FMD灭活疫苗使用A/SKR/Yeoncheon/2017的疫苗抗原(1μg/头份)、10%氢氧化铝凝胶和Montanide ISA 206配制而成。在接种后1、2和3周采血分离血清。
2.4.3猪体液免疫测定(长期)
为长期分析抗体水平,对猪(每组4只)通过肌内注射FMD疫苗、疫苗和Ad-3siRNA的组合或Ad-null control(1×10¹⁰TCID50/头份),不进行加强免疫。在1、3、5和7周采血分离血清。
2.4.4病毒中和试验(VNT)
小鼠和猪血清在56℃下热灭活30 min备用,按照《陆生动物诊断测试和疫苗手册》(WOAH,2022)指南进行病毒中和试验。在LFBK细胞中传代四次的FMDV A/SKR/Yeoncheon/2017用于VNT。
2.4.5小鼠中细胞因子测定
如前所述进行小鼠细胞因子测定。每组4只BALB/c小鼠通过腹腔注射0.1mL的Ad-3siRNA或Ad-null control(3×10⁸TCID50/dose)。在接种后0、16、24和48小时采血分离血清,血清用于使用小鼠IFN-α、IFN-γ、IL-12、IL-6、IL-15和IL-18 ELISA试剂盒测量IFN-α、IFN-γ、IL-12、IL-6、IL-15和IL-18的浓度。通过标准曲线插值确定蛋白质浓度。
2.5猪细胞的逆转录-定量PCR(RT-qPCR)分析
将IBRS-2细胞(1×106个细胞/孔)接种到6孔板中,用50MOI的Ad-3siRNA或Ad-null control感染,并在37°C下孵育。在24和48小时收集细胞。如前所述进行RNA提取、DNase I处理和RT-qPCR。RT-qPCR检测2'-5'OAS、PKR和Mx mRNA的ISG表达分析以及RLR信号相关基因RIG-I、MDA-5和核因子κB激酶ε抑制剂(IKKε)的表达。猪甘油醛-3-磷酸脱氢酶(GAPDH)用作内参。
2.6统计分析
使用GraphPad Prism进行非配对t检验。
3.结果
3.1 Ad-3siRNA对猪细胞I型干扰素的诱导作用
测量用Ad-3siRNA或Ad-null control处理的猪细胞上清液中的IFN蛋白水平和抗病毒活性。与Ad-null control感染的细胞上清液相比,在Ad-3siRNA感染的细胞上清液中,24小时感染后检测到更高水平的猪IFN-α蛋白(图2A,P<0.01)。Ad-3siRNA诱导的干扰素水平从24到48小时显著升高(P<0.05)。48小时,在Ad-3siRNA感染的细胞上清液中检测到猪IFN-β蛋白(图2B,P<0.05)。进行IFN测定,Ad-3siRNA感染的细胞上清液中抗FMDV的抗病毒活性(单位/mL)从24小时增加至48小时(图2C,P<0.05)。同时,在Ad-null control感染的细胞上清液中未检测到抑制活性。
图2.检测用Ad-3siRNA感染的猪细胞的上清液中的I型IFN
(A)猪IFN-α蛋白水平、(B)IFN-β蛋白的水平、(C)使用Ad 3siRNA感染的猪细胞的上清液测量抗FMDV活性
3.2.Ad-3siRNA与FMD疫苗联合在小鼠中引发早期保护和增强的中和抗体水平
为测试Ad-3siRNA与FMD疫苗在接种后1周内的保护效果,监测接种疫苗和Ad-3siRNA的小鼠的存活率(图3A和B)。与PBS组小鼠相比,注射疫苗、疫苗+Ad-null control或疫苗+Ad-3siRNA的小鼠存活率更高。然而,接种后1或7天,疫苗+Ad-3siRNA组的存活率(100%)均显著高于疫苗组或疫苗+Ad-null control组。为评估Ad-3siRNA在接种早期对体液免疫的影响,测量了免疫后3周的中和抗体滴度(VN滴度)(图3C)。疫苗+Ad-3siRNA组在接种后1、2和3周的VN滴度均高于疫苗组或疫苗+Ad-null control组(P<0.05)。后两组之间的VN滴度没有差异。此外,疫苗+Ad-3siRNA组的VN滴度从免疫1到2周逐渐升高(P<00.01)。
图3.小鼠生存曲线和中和抗体水平
(A)在FMDV感染前1天小鼠生存曲线,(B)在FMDV感染前7天小鼠生存曲线(C)血清中和抗体试验结果。虚线表示1:32(log 10 1.5)病毒中和滴度临界水平。
3.3 Ad-3siRNA与口蹄疫疫苗联合应用增强猪体液免疫情况
为评估Ad-3siRNA对自然宿主体液免疫的持续影响,给猪单次注射疫苗或疫苗与Ad-3siRNA(或Ad-null control)的组合,监测免疫后7周中和抗体滴度(图4)。疫苗+Ad-3siRNA组在免疫后第3、5和7周的VN滴度高于疫苗组或疫苗+Ad-null control组(P<00.01)。除第7周外,疫苗+Ad-null control组的VN滴度与疫苗组无差异。此外,尽管未进行加强免疫,疫苗+Ad-3siRNA组的VN滴度从1到7周逐渐升高(P<00.05)。同时,疫苗组的VN滴度从5到7周逐渐下降。
 图4.猪中病毒中和抗体水平
图4.猪中病毒中和抗体水平
3.4 ISG和RLR的上调
测量用Ad-3siRNA或Ad-null control处理的猪细胞中ISG(如寡腺苷酸合成酶(OAS)、粘液病毒抗性(Mx)和PKR)的mRNA水平。与Ad-null control感染或未处理的细胞相比,Ad-3siRNA感染的细胞中观察到显著升高(P<00.05,图5A-C)。在24小时观察到OAS和Mx的mRNA水平增强,在48小时检测到PKR、OAS和Mx的上调。与Ad-null control感染的细胞或未处理的细胞相比,Ad-3siRNA也上调了RIG-I和MDA-5的mRNA水平(P<00.005)(图5D和E)。另一个RLR信号相关基因IKKε在Ad-3siRNA处理后48小时上调(P<00.005)(图5F)。RIG-1、MDA-5和IKKe的mRNA表达从24到48小时逐渐升高(P<00.05)。
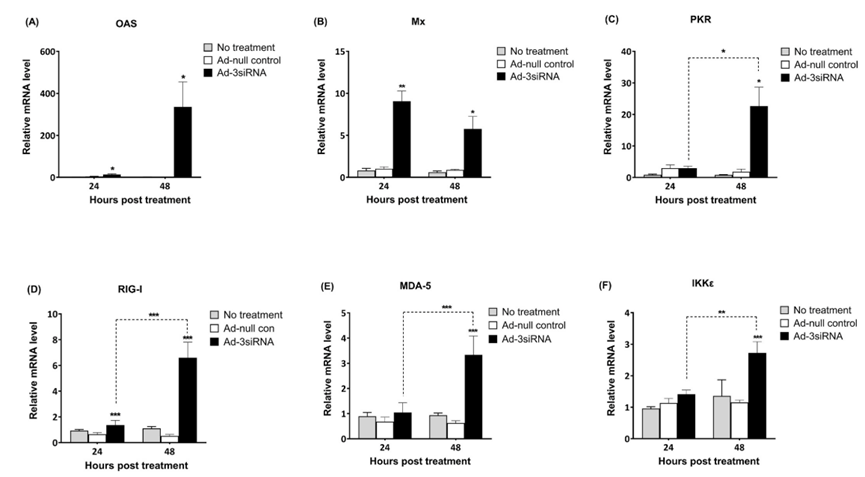 图5.Ad-3 siRNA上调猪细胞干扰素刺激基因和RIG-I样受体信号相关基因表达
图5.Ad-3 siRNA上调猪细胞干扰素刺激基因和RIG-I样受体信号相关基因表达
3.5 Ad-3siRNA在小鼠中诱导细胞因子
为分析Ad-3siRNA在体内诱导的细胞因子,测量腹腔注射Ad-3siRNA的小鼠血清样本中的细胞因子水平。与接种Ad-null control的小鼠相比,注射Ad 3siRNA的小鼠在16-48小时内的IFN-α、IFN-γ、IL-12、IL-6、IL-15和IL-18水平显著升高(图6,P<0.05)。用Ad-null对照感染未显著提高细胞因子水平。IFN-α、IFN-γ和IL-15蛋白水平在16小时升高,48小时达高峰(P<0.05)。IL-12水平逐渐升高,直至24小时,然后在48小时维持不变。IL-6、IL-18在16小时表达量最高,至48 h时仍维持在较高水平。
图6.Ad-3siRNA在小鼠中诱导细胞因子
4.讨论
SiRNA可用于安全快速的抗病毒治疗策略中。然而,外源性siRNA的作用持续时间短,并且靶病毒可进化出抗性机制以避开siRNA。在某些情况下,siRNA诱导先天免疫,从而影响其疗效。然而,免疫激活可能有利于控制病毒感染,isiRNA可能促进长期和广谱的抗病毒作用。在本研究中,我们提出表达多种抗FMDV siRNA的重组腺病毒(Ad-3siRNA)作为一种新型免疫调节剂,它可诱导包括I型IFN在内的多种细胞因子,并与FMD疫苗联合使用时具有佐剂作用。
Ad-3siRNA旨在抑制多种血清型的FMDV。Ad-3siRNA是一种直接作用的FMDV抑制剂,这也是其作用迅速的原因。靶区域是2B和3C基因,已知它们是FMDV基因组中最保守的区域。我们先前观察到仅注射Ad-3siRNA的乳鼠对FMDV有保护作用(7天存活率约90%)。这种抑制可能是由于多种siRNA的基因沉默,而非免疫调节导致,因为乳鼠没有包括先天免疫在内的成熟的免疫系统。此外,由于半衰期短,进行了三次Ad-3siRNA注射。有鉴于此,我们采用Ad-3siRNA与I型IFN(猪IFN-α)联合使用,以克服siRNA的缺点,如作用时间短和因病毒突变而降低效力。I型IFN(或IFN诱导剂)通过增强抗病毒作用和体液免疫,可能是一种有前景的快速有效保护策略。在本研究中,我们清楚地表明Ad-3siRNA在体外和体内诱导I型IFN,因此可有效用作FMD疫苗佐剂。
Ad-3siRNA与FMD疫苗联合使用时,除了增强体内中和抗体的产生外,还刺激了多种细胞因子的产生,如I型IFN、IFN-γ、IL-12、IL-15、IL-6和IL-18。据报道,IFN-α为FMD疫苗的有效佐剂。此外,IFN-γ、IL-12和IL-15参与T细胞免疫并对病毒复制产生抑制作用。IL-18刺激B细胞增殖、IFN-γ产生和辅助性T细胞2(Th2)反应。IL-6也是B细胞活化的关键细胞因子。尽管Ad-3siRNA诱导细胞因子,但我们在实验小鼠和猪中未观察到副作用。在我们的小鼠实验中未观察到体重减轻、异常运动或死亡。在猪实验中,我们同时使用Ad-3siRNA和FMD疫苗,也未观察到死亡、异常运动或皮疹。注射I型IFN或IFN诱导剂的动物通常会出现暂时性体温升高。然而,这种症状通常在1到2天内消失,并且在Ad-3siRNA组中不明显。Ad-3siRNA的佐剂有效性和安全性是剂量依赖性的,应在猪中进行实际应用测试。
除佐剂作用外,Ad-3siRNA诱导I型IFN在控制病毒方面可能具有优势。(1)我们认为Ad-3siRNA的抗病毒作用可能通过其免疫调节作用介导。I型IFN是对抗FMDV产生的最有效的抗病毒蛋白之一。此外,我们观察到小鼠对FMDV的保护作用(100%存活率)在注射后7天得以维持。I型IFN广泛抑制病毒复制并刺激免疫细胞,包括树突状细胞、B细胞和T细胞。(2)尽管Ad-3siRNA最初被开发为一种仅靶向FMDV的siRNA,但我们观察到它具有广泛的抗病毒效果,不仅限于FMDV,还针对BEV和PRRSV。众所周知,I型IFN对多种病毒具有抗病毒作用。在不同种属(如猪、牛和猴)的细胞中观察到这些效应。除了诱导小鼠IFN-α和IFN-β外,还在猪细胞中也诱导猪IFN-α和IFN-β。此外,本研究中使用的人腺病毒载体具有广泛的宿主范围,包括猪和牛。已有几项使用5型人腺病毒载体控制FMDV的研究报道。因此,我们认为Ad-3siRNA可用于不同动物体内抗多种病毒的研究。
人腺病毒5型在HEK293细胞中产生。可产生高滴度的重组腺病毒(10¹¹⁻¹²pfu/mL),并且在HEK293细胞中可进行悬浮培养。我们认为,由于Ad-3siRNA在293细胞中不产生蛋白质,因此在家畜中的应用不需要特殊的纯化过程。我们使用CRISPR Cas-9技术开发了IFNAR KO 293悬浮细胞系,并且在这些细胞系中获得更高滴度的重组腺病毒。因此,我们认为,对于5型腺病毒载体的应用,成本不会是一个重大问题。实际生产成本取决于公司的生产效率。此外,应考虑家畜的效果和成本来确定最佳剂量。
Ad-3siRNA的免疫刺激作用机制尚不清楚。一种可能性是Ad-3siRNA可通过RIG-I和(或)MDA-5信号传导诱导先天免疫。RLRs是检测病原体相关分子模式并启动包括I型IFN表达在内的抗病毒反应的细胞质dsRNA传感器。RLRs包括MDA-5、RIG-I和遗传学与生理学实验室2(LGP2)。其中,MDA-5和RIG-I与病毒RNA的结合触发信号级联以诱导I型IFN表达。我们观察到,尽管在RIG-I敲除细胞和对照细胞中OAS的mRNA水平上调,但在MDA-5敲除细胞中未增强(图S1)。还表明Ad-3siRNA可能是RIG-I和MDA-5的双重激动剂,可上调RIG-I、MDA-5和IKKε的表达。在基因设计方面,我们认为使用多个shRNA和U6(Pol III)启动子表达shRNA可能是Ad-3siRNA诱导I型IFN的关键因素。先前的研究也报道,与Pol II启动子相比,具有U6(RNA聚合酶III)启动子表达shRNA的病毒载体更可能诱导IFN。此外,观察到与三种shRNA不同,用表达由U6启动子驱动的单个shRNA的腺病毒处理的细胞中,ISG mRNA没有上调。因此,有必要详细研究Ad-3siRNA引发的IFN信号传导机制。
总之,我们的研究表明,通过人腺病毒载体递送的新型免疫刺激RNA Ad-3siRNA是一种有前景的佐剂,它可诱导多种细胞因子并通过刺激中和抗体产生来增强FMD疫苗的效果。因此,Ad-3siRNA与疫苗联合使用可能更有效地预防FMD的传播。未来,应探索Ad-3siRNA在不同动物的多种病毒性疾病中的应用,并进行详细的机制研究。
注:以上数据仅供参考,不作任何投资建议
















