摘要
猪流行性腹泻病毒(PEDV)属于冠状病毒科(Coronaviridae)甲型冠状病毒属(Alphacoronavirus),在血清阴性新生仔猪中引起急性腹泻/呕吐、脱水和高死亡率。在过去的三十年里,PEDV感染给欧洲和亚洲的养猪业造成了重大经济损失,但在2013-2014年,该病也在美国、加拿大和墨西哥被报道。从2013年4月至今,美国的PED疫情已导致美国生猪存栏量损失超过10%。
流行性PED的消失和再次出现表明该病毒能够逃脱当前的疫苗接种方案、生物安全和控制系统。地方性PED是一个重大问题,多种PEDV变异株的出现(或潜在输入)加剧了这一问题。流行性PEDV毒株传播迅速,导致大量猪只死亡。这些毒株具有高度肠道致病性,会急性感染整个小肠和大肠的绒毛上皮细胞,但空肠和回肠是主要感染部位。PEDV感染引起急性、严重的萎缩性肠炎,伴有病毒血症,导致严重腹泻和呕吐,继而发生严重脱水,这是哺乳仔猪死亡的主要原因。需要全面了解流行性或地方性PEDV毒株的致病特征,以在受影响地区预防和控制该病,并开发有效的疫苗。本综述重点关注PEDV感染的病原学、流行病学、疾病机制、发病机制以及免疫预防。
引言
猪流行性腹泻病毒(PEDV)属于套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)甲型冠状病毒属(Alphacoronavirus),在新生仔猪中引起急性腹泻、呕吐、脱水和高度死亡,导致重大经济损失。该病最初在过去30年里在欧洲和亚洲的养猪业中被报道,该病毒最早于20世纪70年代初出现在英格兰和比利时。最近,PEDV也在美国被报道。此后,该病毒在美国全国范围内迅速传播,并传播到北美其他国家,包括加拿大和墨西哥。由于PEDV的显著影响,在仅一年的流行期后,美国养猪业损失了其国内生猪存栏量的近10%,相当于约700万头仔猪。
PEDV与另一种甲型冠状病毒,传染性胃肠炎病毒(TGEV)之间相似的流行病学和临床特征导致诊断复杂化,需要进行鉴别性实验室检测。自1984年TGEV的一种天然刺突蛋白基因缺失突变体——猪呼吸道冠状病毒(PRCV)出现以来,由于与TGEV存在交叉保护性免疫,TGEV在PRCV血清阳性的猪群中传播减少。相比之下,PEDV继续在全球传播并造成经济问题。
基于遗传分析,冠状病毒科可分为四个属:甲型冠状病毒属(Alphacoronavirus)、乙型冠状病毒属(Betacoronavirus)、丙型冠状病毒属(Gammacoronavirus)和丁型冠状病毒属(Deltacoronavirus)。认为蝙蝠是甲型和乙型冠状病毒的基因来源宿主,而鸟类被认为是丙型和丁型冠状病毒的疑似宿主。在PEDV流行的美国不同地区,一种在遗传上与PEDV不同的新型冠状病毒——猪丁型冠状病毒(PDCoV),经常同时出现在猪的腹泻粪便样本中。据报道,PDCoV在田间临床影响和疾病严重程度低于PEDV。最近的一项研究证实,PDCoV对猪具有肠道致病性,会急性感染小肠,引起严重腹泻和/或呕吐以及萎缩性肠炎,其临床症状与PEDV和TGEV感染相似。目前,对PEDV、PDCoV和TGEV的鉴别诊断对于控制美国养猪场病毒性流行性腹泻至关重要。
本综述重点关注当前对PEDV的病因学、流行病学、疾病机制、发病机制的理解以及可用于预防PEDV感染的控制措施。
1 病原学
1.1 PEDV的结构与基因组
PEDV具有包膜,呈多形性,直径范围(包括突起)为95-190 nm,突起长度约为18 nm。PEDV结构和基因组的详细信息可参见其他文献。PEDV具有一个大小约为28 kb的单股正链RNA基因组(不包括poly A尾),编码四种结构蛋白:刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N),以及四种非结构蛋白:1a、1b、3a和3b。在病毒蛋白中,S蛋白对于调节与特定宿主细胞受体糖蛋白的相互作用以介导病毒进入以及诱导中和抗体至关重要。S蛋白还与PEDV在体外的生长适应性及体内毒力的减弱有关。M蛋白是包膜中最丰富的病毒蛋白成分,通过与S蛋白和N蛋白相互作用,在病毒组装中发挥重要作用。冠状病毒的N蛋白结合RNA并将病毒基因组RNA包装到病毒颗粒的核衣壳中。
1.2 PEDV的生物学和理化特性
先前一项使用细胞适应性德国分离株V215/78的研究记录了PEDV的生物学和理化特性。PEDV的浮力密度为1.18。PEDV易被乙醚或氯仿灭活,与较高温度相比,在4–50°C下相对稳定。在细胞培养基中于4°C、pH范围(3-10)下孵育6小时后,PEDV表现出低到中等的残留感染性;而在37°C下孵育6小时,仅在pH范围5-8.5之间保留其感染性,在pH<4和>pH 9时病毒完全失活。这些数据表明,如果在较高温度(>37°C)下应用酸性或碱性消毒剂一定时间,PEDV将被灭活。
PEDV毒株V215/78不能被TGEV抗血清中和。这一发现得到了另一份报告的支持,该报告通过免疫电镜和免疫荧光(IF)检测发现,PEDV CV777毒株与比利时TGEV毒株或猫传染性腹膜炎病毒(FIPV)均无交叉反应性。然而,随后的研究发现,通过更灵敏的检测方法,如酶联免疫吸附试验、免疫印迹和免疫沉淀,PEDV和FIPV之间存在可检测的双向交叉反应性。这些差异表明,PEDV与其他冠状病毒之间的交叉反应性可能因技术灵敏度和测试的病毒株而异。最近的一项研究报告了原型CV777和近期美国PEDV毒株与TGEV(Miller毒株)之间存在抗原交叉活性的证据,因为它们在其N蛋白的N末端区域至少共享一个保守表位。
1.3 PEDV的灭活
Pospischil等人(2002)证明PEDV可被消毒剂灭活,即氧化剂(Virkon S)、漂白剂、酚类化合物(One-Stroke Environ;Tek-Trol)、2%氢氧化钠、甲醛和戊二醛、碳酸钠(4%无水或10%结晶,含0.1%洗涤剂)、离子和非离子洗涤剂、1%强效碘伏(溶于磷酸中)以及脂溶剂如氯仿。
1.4用于病毒分离的细胞培养
Vero(非洲绿猴肾)细胞支持在补充有外源性蛋白酶胰蛋白酶的细胞培养物中分离和连续传代培养PEDV。另一种非洲绿猴肾细胞系MARC-145也支持PEDV的后续细胞传代。胰蛋白酶在PEDV病毒粒子进入Vero细胞和释放中发挥重要作用,有助于病毒在体外有效复制并传播到邻近细胞。胰蛋白酶导致S蛋白裂解为S1和S2亚基,这很可能是细胞间融合以及病毒粒子从感染的Vero细胞中释放的原因。细胞病变效应包括空泡化和合胞体形成,这是细胞凋亡性死亡的结果。PEDV的血凝活性仅在胰蛋白酶处理后才能在兔红细胞上得到证实。不同国家报道的PEDV只有一个血清型。
2 流行病学
2.1 PEDV全球流行病学
PEDV最早于20世纪70年代初出现在英国(Wood,1977)和比利时。该病毒于1977年在比利时首次分离,并被归类于冠状病毒科。随后,在20世纪80年代和90年代,PEDV在日本和韩国被确认为是造成严重流行的原因。尽管广泛应用了PEDV疫苗,PED在韩国仍然呈地方性流行。
在20世纪80年代和90年代的欧洲,PED暴发并不频繁,但该病毒继续传播并以地方性形式在猪群中持续存在。随后的血清学调查显示欧洲猪群中PEDV的流行率为低到中度。然后,欧洲猪群中PEDV的流行率大幅下降,尽管原因尚不清楚。PED的暴发在欧洲仅零星观察到:1989-1991年在荷兰;1995年在匈牙利,以及1998年在英格兰。然而,2005-2006年在意大利发现了一次典型的流行性PED暴发。
2007-2008年在泰国,报道了几次严重的PED暴发,其泰国PEDV分离株在系统发育上与中国的JS-2004-2毒株属于同一分支。这种新基因型的PEDV继续在泰国引起零星暴发。
2010-2012年在中国,不同地区报道了血清阳性猪群中严重的PED暴发。自PEDV首次在中国出现近二十年来,许多猪群都接种了原型毒株CV777灭活疫苗或相关疫苗。然而,接种疫苗猪群中哺乳仔猪的中到高度死亡率表明CV777疫苗有效性较低。2010-2012年中国的PED暴发是由经典的和新的PEDV变异株共同引起的,这些变异株在遗传上不同于原型CV777。
2.2 2013-2014年美国PEDV分子流行病学
2013年首次暴发期间鉴定的美国PEDV毒株在遗传上与2011-2012年报道的中国毒株(China/2012/AH2012)密切相关,表明类似AH2012的中国PEDV毒株在美国出现。类似美国的PEDV毒株也在2013年末和2014年初在韩国和台湾的腹泻仔猪中发现,但中国或美国的PEDV毒株是否可能传播到韩国和台湾的猪尚不清楚。需要进一步调查以澄清在相关暴发首次被发现之前,中国或美国的PEDV毒株是否已经存在于韩国和台湾。
首次暴发后不到一年,发现了其他新型美国PEDV毒株(OH/OH851),其S基因存在多处缺失和插入,与中国的HBQX-2010或CH/ZMZDY/11毒株关系密切,而非AH2012。与主要的美国PEDV毒株相比,这些毒株在5'端S1区域(前1170个核苷酸)具有较低的核苷酸同源性,而在剩余的S基因中具有较高的核苷酸同源性。涉及中国毒株的可能的重组事件可能促进了美国PEDV的快速进化和多种变异株的出现,使美国PEDV毒株的分子流行病学复杂化。
值得注意的是,首次暴发仅一年后,出现了另一种PEDV变异株,该变异株在主要细胞培养的美国PEDV毒株(如PEDV毒株TC-PC22A,GenBank登录号KM392224)的S蛋白N端部分存在一个大的197个氨基酸(aa)缺失。在韩国PEDV毒株中也鉴定出另一种在S蛋白713-916位点存在大片段(204 aa)缺失的PEDV变异株。
2.3传播
粪-口途径是PEDV传播的主要方式,尽管气溶胶化的PEDV仍具有感染性。腹泻粪便和/或呕吐物以及其他受污染的污染物,如运输拖车和饲料,可能是该病毒的主要传播源。PEDV的另一个可能的储存库包括携带者,例如无症状感染的年长猪,病毒在其中以亚临床方式传播。
先前的研究显示,在受感染的哺乳母猪的乳汁样本中,PEDV RNA的检出率较低到中等(23-41%),表明母猪乳汁可能是PEDV垂直传播的潜在途径。我们的研究表明,在实验感染仔猪或自然感染生长猪的急性期血清样本中,PEDV RNA的检出率显著(55-100%)。用作饲料添加剂的猪血浆是否可能是PEDV的传播源仍有疑问,因为两项不同的感染研究报道了不一致的结果,这些研究调查了检测出PEDV RNA阳性的喷雾干燥猪血浆是否对血清阴性猪具有传染性。
3 PEDV的疾病机制与发病机制
3.1 PEDV的组织嗜性
猪小肠绒毛肠细胞大量表达氨肽酶N(APN),这是一种150-kDa的糖基化跨膜蛋白,被鉴定为PEDV的细胞受体。肠细胞上高密度的受体使PEDV能够通过病毒-受体相互作用进入并复制。PEDV具有细胞溶解性,受感染的肠细胞迅速发生急性坏死,导致小肠(而非大肠)出现显著的绒毛萎缩(图1A)。PEDV抗原主要在小肠(十二指肠至回肠)(图1B)和大肠(直肠除外)的绒毛肠细胞中观察到。
与TGEV类似,PEDV可能不会诱导感染猪小肠肠细胞的凋亡性死亡(图1C,D)。在感染后期,偶尔在肠隐窝细胞或派伊尔氏结中检测到少量PEDV阳性细胞。在我们的初步研究中,无菌猪在接种后小时(PHI)30-72时,每个肠绒毛的平均杯状细胞数量(<2个/绒毛)少于阴性对照猪(6-18个/绒毛)(图2)。
与TGEV类似,PEDV可能感染杯状细胞,导致腹泻早期该细胞类型数量急剧减少。杯状细胞分泌粘蛋白,提供肠道抵抗微生物的第一道防线。经口鼻感染的猪的肺组织PEDV抗原呈阴性,表明下呼吸道没有PEDV复制的证据。在其他主要器官,如幽门、扁桃体、脾脏、肝脏和肾脏中未检测到PEDV抗原。然而,最近的一项研究报道了PEDV在猪肺巨噬细胞中的体外和体内复制。仍不确定PEDV是否发生肠外复制。
3.2疾病进展过程中PEDV在肠道的复制
PEDV结合并感染表达APN的肠细胞。病毒在受感染的肠细胞中通过内质网和高尔基体等胞质内膜出芽迅速组装。在潜伏期,整个小肠可见PEDV抗原阳性细胞,多达30-50%的吸收上皮细胞呈阳性,这与感染急性期无症状猪的粪便排毒一致。从感染的急性期到中期(临床症状出现后24-60小时),整个小肠和大肠可见中等到大量的PEDV抗原阳性细胞,常累及整个绒毛上皮。在感染后期(临床症状出现后>72小时),仍观察到大量PEDV感染的上皮细胞,提示PEDV对再生的肠细胞存在再感染。
3.3病理生理学
PEDV引起的腹泻是由于大量吸收性肠细胞损失导致的吸收不良的结果。受感染肠细胞的功能障碍也促成了吸收不良性腹泻。在电镜下检查受感染的肠细胞,细胞质电子密度降低和线粒体快速变性导致吸收所需的转运能量缺乏。在受感染的结肠上皮细胞中观察到的超微结构变化和轻度空泡化可能干扰水和电解质的重要重吸收。呕吐加剧了脱水,但PEDV感染诱发呕吐的机制尚不清楚。
类似于急性TGEV感染中的高钾血症和酸中毒,我们的初步研究表明,在出现严重水样腹泻后1天,接种PEDV的仔猪表现出高钠血症、高钾血症和高氯血症,但钙和碳酸氢盐水平低。腹泻仔猪小肠中刷状缘膜结合的消化酶,如双糖酶(乳糖酶、蔗糖酶、和麦芽糖酶)、亮氨酸APN和碱性磷酸酶显著降低。小肠中酶活性的降低导致消化不良性腹泻。在我们的初步研究中,在PHI 30-120时,受感染无菌猪的小肠中观察到紧密连接蛋白(ZO-1)和粘附连接蛋白(E-钙粘蛋白)的分布紊乱、不规则以及表达减少(图3)。受损的肠道完整性可能导致水分因PEDV感染引起的高渗透压而流失到肠腔,并摄取肠腔细菌引起混合感染。
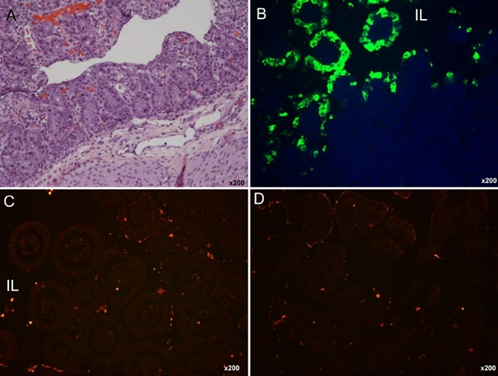
Fig.1.接种美国PEDV株PC 21 A的无菌猪的肠道中的组织病理学、通过免疫荧光染色定位猪流行性腹泻病毒(PEDV)抗原,以及通过原位端粒检测的细胞死亡。(A)接种后46小时(出现临床体征时),接种猪的经莫林和伊红(H&E)染色的肠,显示急性弥漫性、严重萎缩性甲状腺炎,绒毛高度与阴囊深度之比(VH:CD)&T&原始放大倍数x 200。(B)PIH 30(出现临床症状后4-5小时)接种猪的肠免疫荧光(IF)染色,显示萎缩绒毛内衬的表皮细胞PEDV抗原呈阳性。原始放大倍数x 200。(C)与D组(阴性对照)相比,对接种猪福尔马林固定的、蜡包埋的肠进行原位TLR染色(B组),显示通过IF染色对PEDV抗原呈阳性的内皮萎缩绒毛中的TLR阳性(细胞死亡)细胞(红色染色)没有增加。原始放大倍数x 200。(D)对未接种的阴性对照猪的福尔马林固定、蜡包埋的肠肠绒毛皮中进行原位TLR染色,显示肠绒毛皮中很少有TLR阳性(细胞死亡)细胞(红色染色)。注意固有层中有一些TLR阳性细胞(红色染色)。原始放大倍数x 200。IL,肠腔。在B组中,细胞核用蓝色荧光4′,6-二脒基-2-苯基吲哚二盐酸盐染色。TLR,原位末端去氧核苷转移酶修饰的dGPT缺口末端标记。
3.4 PED的抵抗力与日龄关系
PEDV感染在哺乳仔猪中比在断奶猪中诱导更严重的疾病和死亡的机制尚未明确阐明。几个可能影响哺乳仔猪对PEDV感染易感性更高和疾病恢复时间更长的解剖学和生理学因素包括:新生仔猪肠细胞更新较慢(5-7天),而3周龄断奶猪为2-3天。
肠道上皮的高更新率依赖于在肠隐窝中发现的干细胞。肠道干细胞主要包括三种细胞类型:LGR5(富含亮氨酸重复序列的G蛋白偶联受体5)阳性隐窝基底柱状细胞(LGR5+细胞)、+4细胞和潘氏细胞(Paneth cells)。然而,猪肠道中是否存在潘氏细胞存在争议。
我们的初步研究揭示了在PEDV感染猪的隐窝细胞层中存在大量LGR5+细胞(图4),表明存在对PEDV感染急性期上皮细胞更新至关重要的干细胞。该研究还揭示了在未感染PEDV的哺乳仔猪(9日龄)小肠中缺乏LGR5+细胞且隐窝细胞增殖低下(隐窝细胞中Ki67蛋白表达少),可能导致肠细胞更新缓慢。然而,在PEDV感染后3-5天,LGR5+细胞的数量和隐窝细胞的增殖显著增加,导致替换从受感染绒毛脱落的坏死肠细胞。另一方面,未感染PEDV的断奶猪(3周龄)表现出高隐窝细胞增殖能力和隐窝中存在大量LGR5+细胞,这与肠细胞的快速更新率有关。大量的LGR5+细胞和隐窝细胞的高繁殖得以维持,可能导致断奶猪从PED中迅速恢复。
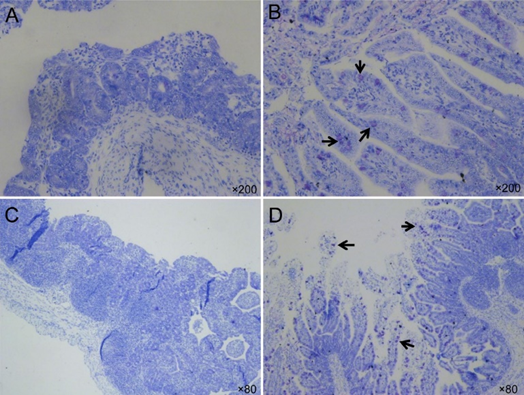
图2。通过甲氧胺蓝染色确定,接种美国猪流行性腹泻病毒(PEDV)株PC 21 A的无菌猪的小肠杯状细胞数量减少。(A)接种后72小时(出现临床症状后26-28小时)接种猪的甲状腺,每个绒毛显示很少有杯状细胞。原始放大倍数,x 200。(B)阴性对照猪的甲状腺,每个绒毛显示少量至中等数量的杯状细胞(箭头)。原始放大倍数,x 200。(C)PIH 72(出现临床症状后26-28小时)接种猪的免疫结果,每个绒毛显示很少有杯状细胞。原始放大倍数,x 80。(D)阴性对照猪的图像,显示每个绒毛中有中等至大量的杯状细胞(箭头)。原始放大倍数,x 80。
3.5病毒血症
在接种美国PEDV毒株(PC21A)的无菌仔猪感染急性期至后期阶段检测到病毒血症,血清中病毒RNA范围在4.8至7.6 log10基因组当量(GE)/mL之间。在田间样本中也观察到类似结果,显示从13-20周龄腹泻猪收集的20份急性期血清样本中有11份(55%)含有病毒RNA滴度(4.0–6.3 log10 GE/mL)。早期严重的腹泻/呕吐和高PEDV粪便排毒滴度可能伴随病毒血症,但尚未有人证实在血清中存在感染性病毒。
3.6对PEDV的免疫反应
关于对PEDV的先天性和适应性免疫反应的信息匮乏。PEDV感染后,在小肠固有层中观察到淋巴细胞(在PHI 30-120时为CD4+和CD8+T细胞)(图5)、单核细胞、嗜酸性粒细胞和中性粒细胞的浸润。在接种CV777毒株的常规猪中研究了全身和粘膜相关淋巴组织中的同种型特异性抗体分泌细胞以及血清抗体反应。表达PEDV E蛋白的培养肠上皮细胞在体外上调白细胞介素(IL)-8的表达。
3.7 PEDV的减毒
流行性PEDV毒株的致病性通常很严重,表现为受感染哺乳仔猪的高死亡率。然而,通过高代次细胞培养传代(93-100代)引起PEDV毒株的毒力减弱。与其亲本野生型毒株相比,减毒的PEDV毒株在其S基因和开放阅读框3(ORF3)基因中存在多处核苷酸变化。在ORF3的652个核苷酸中,在亲本野生型DR13 PEDV和经细胞传代适应(100代)并被证实减毒的PEDV之间鉴定出两个缺失和七个变化。值得注意的是,两种减毒PEDV毒株——韩国DR13(100代)和日本83P-5(100代)的S基因与其亲本病毒相比,具有显著相似性,存在可比的核苷酸突变和氨基酸(aa)替换。减毒的83P-5在S基因中有18个核苷酸突变和13个预测的aa替换。
同样,对美国PEDV毒株和体外传代病毒(在MARC-145细胞中传10代)的序列分析表明,细胞培养适应过程特异性地修饰了PEDV S蛋白(6个aa替换)而开放阅读框1a/b(ORF1a/b)编码的多聚蛋白、ORF3、E、M和N蛋白保持不变。PEDV S基因中的多处核苷酸突变和aa替换可能有助于其体内致病性的减弱,但需要对整个PEDV基因组进行测序以验证减毒后的其他变化。
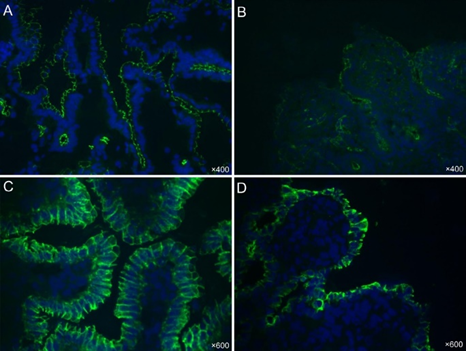
Fig.3.通过免疫荧光染色显示美国猪流行性腹泻病毒(PEDV)PC21A接种的无菌猪小肠中紧密连接蛋白(ZO-1)(A,B)和粘附连接蛋白(E-钙粘蛋白)(C,D)的表达。(A)阴性对照猪的空肠,显示绒毛上皮细胞顶表面ZO-1(绿色染色)分布良好、表达广泛。原始放大倍数,×400。(B)接种猪在接种后小时(PHI)30(临床症状出现后4-5小时)的空肠,显示与阴性对照(图A)相比,绒毛上皮细胞顶表面ZO-1(绿色染色)分布紊乱、不规则,表达中度减少。原始放大倍数,×400。(C)阴性对照猪的空肠,显示绒毛上皮细胞顶表面和基底外侧表面以及细胞质中轻度表达的E-钙粘蛋白(绿色染色)分布良好、表达广泛。原始放大倍数,×600。(D)接种猪在PHI 30(临床症状出现后4-5小时)的空肠,显示与阴性对照(图C)相比,绒毛上皮细胞顶表面和基底外侧表面的E-钙粘蛋白(绿色染色)分布紊乱、不规则,表达中度减少。原始放大倍数,×600。细胞核用蓝色荧光染料4',6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色。使用针对人重组ZO-1和E-钙粘蛋白(Invitrogen)的单克隆抗体进行免疫荧光染色。
4 流行性PED(PEDV感染的流行形式)与地方性PED(PEDV感染的地方形式)
4.1流行性猪流行性腹泻
典型的流行性PED导致的详细临床疾病和并发症在1976-1977年英国的血清阴性种猪场、1977年比利时、1982-1983年日本、2005-2006年意大利、2007-2008年泰国和2013年美国均有记载。血清阴性猪场的临床暴发特点是所有年龄段的猪突然爆发严重的腹泻和/或呕吐,伴有厌食和食欲显著下降。
临床症状的严重程度和死亡率似乎与猪的年龄呈负相关。在断奶猪至育肥猪(包括怀孕母猪)中,临床症状在疾病开始后5-10天内呈自限性,其严重程度不如2周龄以下的哺乳仔猪。当怀孕母猪在病毒暴露后获得免疫力时,它们通过乳汁免疫保护其后代。疾病从开始到停止的间隔通常为3-4周,然而临床症状主要在血清阴性的哺乳母猪及其哺乳仔猪中发生。在分娩猪群中,仔猪发病率可达100%,但母猪发病率各异。2周龄以下仔猪在出现严重水样腹泻和/或呕吐后3-5天,死亡率可超过95%(平均50%)。
对1976-1977年英国(Wood,1977)和2013年美国流行性PED的田间观察以及实验结果表明,PEDV在检测到临床症状前的潜伏期有所不同,范围从1到7天(美国PEDV)或5-8天(英国PEDV)。使用原型CV777的实验研究表明,3-15日龄的剖腹产、未食初乳(CDCD)仔猪在PHI 22-36内出现腹泻。另一项美国PEDV感染研究使用10-35日龄无菌猪(接种剂量6.3-9.0 log10 GE),显示严重腹泻和/或呕吐通常在PHI 24-48内检测到。与CDCD或无菌猪不同,接种中国PEDV毒株(3.2–3.3 log10 50%组织培养感染剂量TCID50)的常规哺乳仔猪在检测到临床症状前有较长的潜伏期(接种后3-6天)。
4.2地方性PED与细菌和病毒的混合感染
由地方性PED引起的详细临床疾病和问题在1989-1991年荷兰的一个自繁自养猪场(farrow-to-finish farm)中有记载。在1989年的暴发期间,腹泻在育肥猪和怀孕母猪中最严重,在哺乳和断奶仔猪中表现轻微或没有,且无死亡。在首次暴发开始后至少18个月内,PEDV在该猪场成为地方性流行,感染持续存在于新引入的血清阴性后备母猪或6-10周龄猪中。另一种典型的地方性PED已在韩国养猪场显现。韩国猪场使用三种韩国毒株DR13、KPEDV-9和SM98-1或一种日本毒株P-5V的活疫苗或灭活疫苗。研究报告称,近期流行的韩国PEDV田间分离株与中国毒株关系密切,在遗传上不同于韩国使用的四种疫苗株和原型CV777。这种历史疫苗株与近期田间PEDV毒株的分歧可能降低了疫苗效力,导致在韩国猪群中难以从存在地方性PED的猪场根除PEDV。
与地方性TGE类似,被动免疫的哺乳仔猪中与PEDV相关的死亡率和发病率低于血清阴性猪)。地方性PED主要表现于断奶猪,哺乳仔猪临床疾病的严重程度可能因其他肠道病原体的混合感染而加剧,如大肠杆菌(中国仔猪3%或加拿大仔猪9%),或病毒包括猪圆环病毒2型(PCV2)(韩国仔猪30-33%)、TGEV(中国仔猪8%)和轮状病毒(中国仔猪4%)。
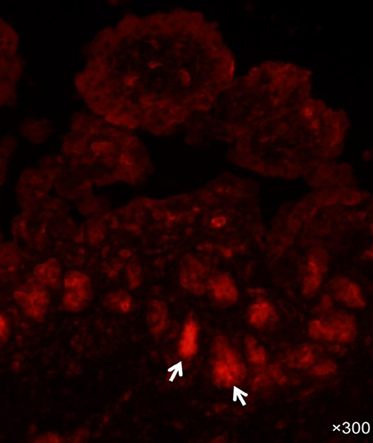
Fig.4.通过免疫荧光染色显示美国猪流行性腹泻病毒(PEDV)毒株PC21A接种的无菌猪小肠中LGR5+隐窝干细胞的定位。PEDV接种猪在接种后小时30(临床症状出现后4-5小时)的空肠,显示在萎缩绒毛的隐窝细胞层中有大量LGR5+隐窝干细胞(红色染色:箭头)。原始放大倍数,×300。使用针对人LGR5(Novus Biologicals)的多克隆抗体进行免疫荧光染色。LGR5+隐窝干细胞,即LGR5(富含亮氨酸重复序列的G蛋白偶联受体5)阳性隐窝基底柱状细胞。
5 病变
5.1大体病变
大体病变仅限于胃肠道,其特征是肠壁(十二指肠至结肠)变薄透明,肠腔内积聚大量黄色液体。胃内充满凝乳,可能是由于肠道蠕动减弱所致。经常检测到肠系膜血管充血,肠系膜淋巴结(MLN)水肿。常见缺乏肠乳糜管,这是吸收不良的一个指标。尽管持续严重腹泻,感染猪在腹泻开始后3-5天仍有低到中度食欲,之后变得濒死。
5.2组织学病变
组织学病变包括急性弥漫性、严重的萎缩性肠炎,以及盲肠和结肠浅表上皮细胞的轻度空泡化和上皮下水肿。基于电镜观察,四只感染CV777的仔猪中有一只结肠上皮细胞有超微结构变化,但缺乏组织学损伤。
在急性感染期间,在空肠绒毛的顶端或整个绒毛上可见空泡化的肠细胞或大量细胞脱落。萎缩的绒毛常融合在一起,并被退变或再生的扁平上皮覆盖。固有层中炎症细胞浸润明显。十二指肠的李贝昆氏腺(隐窝)表现正常。在经口和/或鼻感染的仔猪的脾脏、肝脏、肺、肾脏和MLN中未发现病变。
在潜伏期,即临床症状出现前,感染猪的绒毛长度正常,但存在发生坏死的空泡化肠细胞。在腹泻开始后1-3天,感染猪表现出严重的绒毛缩短。在感染后期(临床症状出现后84-120小时)安乐死的仔猪有中度至重度绒毛萎缩,提示持续的细胞坏死。PEDV感染后,肠隐窝层包含LGR5+细胞(图4)和对增殖细胞标志物Ki67蛋白呈阳性的隐窝细胞。PEDV诱导的吸收不良性腹泻的发生时间和严重程度可能取决于空肠绒毛萎缩的程度以及隐窝干细胞替换的速度。
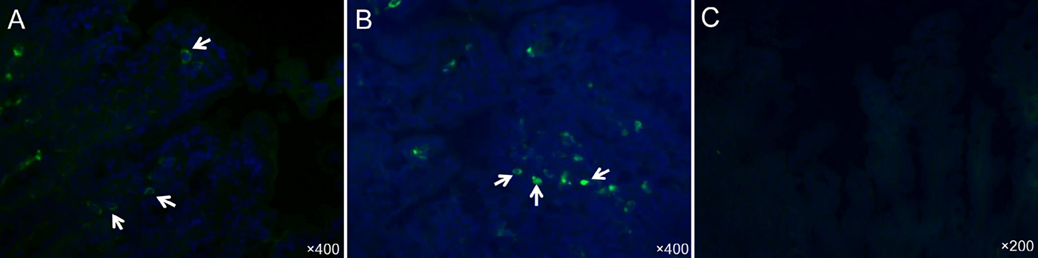
Fig.5.通过免疫荧光染色显示美国猪流行性腹泻病毒(PEDV)毒株PC21A接种的无菌猪小肠中CD4或CD8阳性T细胞的定位。(A,B)临床症状出现后120小时接种猪的空肠,显示固有层中有少量到中等数量的CD4+(A)和CD8+(B)T细胞(箭头)。原始放大倍数,均为×400。(C)未接种的阴性对照猪的空肠,在肠道切片中未检测到CD4+T细胞。原始放大倍数,×200。细胞核用蓝色荧光染料DAPI染色。
6 免疫预防作为预防策略
6.1流行性PED
当PED发生在血清阴性种猪场时,怀孕母猪的免疫或疫苗接种对于控制流行性PED和减少哺乳仔猪死亡数量至关重要。如果母猪在2周或更长时间内分娩,可以通过暴露于强毒自身病毒(如来自受感染新生仔猪的粪便浆液或切碎的肠道)进行免疫。然而,存在潜在风险,即PEDV感染仔猪粪便或肠道中含有的其他致病病毒(如PCV2)可能通过垂直传播途径在母猪或其哺乳仔猪中意外广泛传播。通过乳汁被动免疫为新生仔猪提供针对TGEV感染的即时保护的重要性和机制已由Saif等人(2012)综述。
欧洲、亚洲和美国的所有流行性PEDV毒株都具有高度肠道致病性,表现为受感染哺乳仔猪的高死亡率。然而,韩国(KPEDV-9和DR13)或日本(83P-5)PEDV毒株的毒力可以通过高代次细胞培养传代(93-100代)诱导减弱(。此外,减毒的细胞适应性PEDV毒株已被用作口服(仅韩国DR13毒株)或肌肉注射(IM)活病毒疫苗。肌肉注射减毒KPEDV-9 PEDV疫苗(1 mL,107 TCID50/mL;分娩前2或4周两次注射)将接种5个50%致死剂量(LD50)亲本野生型毒株仔猪的40%死亡率降低为0%,将接种10个LD50仔猪的100%死亡率降低为80%。
其效力可能与疫苗接种母猪血清和初乳中高水平的PEDV特异性IgG有关。一项使用肌肉注射减毒DR13 PEDV活疫苗(1 mL,107 TCID50/mL;分娩前2或4周两次注射)的研究,将接种高剂量亲本DR13仔猪的100%死亡率降低到60%。基于这些观察,怀孕母猪可以通过肌肉注射途径使用减毒PEDV毒株进行疫苗接种,但未观察到在哺乳仔猪中诱导完全保护。
6.2地方性PED
对哺乳猪或育肥猪进行主动免疫对于控制地方性PEDV感染很重要。一项田间研究表明,与肌肉注射途径相比,在分娩前2或4周两次口服减毒PEDV(DR13毒株)疫苗在增强或启动怀孕母猪及其哺乳仔猪(3日龄)的免疫力方面更有效。与接种相同剂量肌肉注射疫苗的对照组相比,接种疫苗的母猪及其仔猪在初乳或血清中表现出更高的IgA(粘膜免疫)和病毒中和抗体(体液免疫)水平。然而,与TGEV感染中观察到的情况类似,接种疫苗猪体内母源抗体的存在可能会干扰PEDV感染后主动抗体的产生。口服活疫苗株在遗传上是否稳定且在田间是否保持无传染性需要进一步研究。
结论
流行性PED的消失和再次出现表明PEDV能够有效地逃脱当前的疫苗接种方案、生物安全和控制系统。地方性PED是一个重大问题,多种PEDV变异株的出现或潜在输入到其他国家加剧了这一问题。流行性PEDV毒株传播迅速,导致大量猪只死亡和重大经济损失。这些毒株具有高度肠道致病性,会急性感染整个小肠和大肠的绒毛上皮细胞,尽管空肠和回肠是主要感染部位。PEDV感染引起急性、严重的萎缩性肠炎,伴有病毒血症(病毒RNA),导致严重腹泻和呕吐,继而发生严重脱水和血液电解质失衡,这是哺乳仔猪死亡的主要原因。需要更好地了解流行性或地方性PEDV毒株的致病特征,以在受影响地区预防和控制该病,并开发有效的疫苗。
感染PEDV的血清阴性哺乳仔猪的高死亡率最可能与严重绒毛萎缩导致的大量脱水有关。在受感染的哺乳仔猪中,肠道隐窝细胞增殖增加,LGR5+隐窝干细胞数量增多,受损肠上皮重组,成熟肠细胞向绒毛顶端迁移,但这些可能不足以防止哺乳仔猪发生严重脱水。田间PEDV感染哺乳仔猪脱水发生的时间似乎太短,使得动物无法通过隐窝干细胞自然发生的上皮细胞更新从疾病中恢复。需要进一步的研究来确定哺乳仔猪与断奶猪肠道干细胞组织和迁移以替换PEDV感染的绒毛上皮细胞的程度。促进干细胞再生或成熟的药理学或生物学介质,如表皮生长因子,将是尝试缩短上皮细胞更新时间并减少PEDV脱水死亡损失的有趣靶点。
注:以上数据仅供参考,不作任何投资建议
















