常温保存技术是我国猪场普遍使用的猪精液保存技术,实践证明,在配制精液稀释液时添加一些酸性物质或一定量的CO2可降低精液中pH,可降低精子日常新陈代谢和各种能量的消耗,且使精子达到可逆状态。常温下液态保存的猪精液具有受精率高、产仔率高等优点。因此,常温保存更有利于提高优质种公猪利用率。影响精液常温保存效果有诸多因素,除猪精液本身外,稀释液品质也是影响精液保存效果的关键因素。稀释液不仅可以为精子补充能量,提供营养物质,还可以保护精子,延长精子在体外的生存时间。稀释粉的配方成分一般具有为精子提供所需营养、适宜生存环境等特征。
稀释粉按照成分及保存时间可分为短效、中效和长效稀释粉。短效稀释粉可保存精液1~3 d,BTS与BL-1是常见的短效稀释粉。BTS稀释后精液保存3 d后,精子活率可达到80%左右,产仔率可达到75%左右;BL-1稀释后精液保存1 d和3 d时,分娩率分别可达到65.9%、52.7%。中效稀释粉可保存精液3~5 d。如法国Passion中长效稀释液保存3 d后的精子活力可达到0.82左右。长效稀释粉一般可保存精液5 d以上。如中国力之源可以保存精液7~14 d。我国大部分规模化猪场使用的稀释粉均为进口产品,如河南的养猪场每年所购稀释粉的费用占人工受精成本的30%以上。国产与进口稀释粉在我国稀释粉市场上的比例大约为1:19。
目前,猪精液常温保存的稀释粉配方种类较多,但因猪品种及稀释粉配方有一定差异,使一部分稀释液存在产生效果不稳定、母猪受精率低、产仔数低等缺点。为了解不同猪精液稀释液常温保存的效果,延长液态下猪精液的保存时间,提高优良种公猪利用率,本试验选取市面常见两种稀释粉和实验室改良的Modena稀释粉,对猪精液进行常温保存试验。通过对添加三种稀释粉的猪精液中精子的活率、活力、运动参数、畸形率以及精液pH等指标进行检测,探讨三种稀释液在常温保存条件下对猪精子各项指标的影响,选出三种稀释粉中更适合常温保存的稀释粉。
1 材料与方法
1.1 试验材料及试剂
产自某生物科技有限公司稀释粉1、德国产猪精液稀释粉2、本实验室改良的Modena稀释粉3、蒸馏水等。
1.2 猪精液的采集
试验的猪精液来自黑龙江省大庆市大庆精育种公猪站的8头成熟健康的长白种公猪,采集后的精液保存在保温瓶中2 h内带回实验室进行试验。
1.3 稀释液的配置
从市面上多种稀释粉中选取两种价格相对低廉,性能和使用效果较好的稀释粉配制而成的稀释液以及实验室改良的Modena稀释液进行本次试验,将选取的稀释粉(47 g)逐渐加入到1 L、35℃的蒸馏水中,进行搅拌,使稀释粉充分溶解。将溶解后的稀释液与需要进行试验的猪精液调至成相同的温度,以备后续使用。在后续的试验分析中,将三种不同稀释液标记为稀释液1(火球稀释液 )、稀释液2(Anderostar Plus稀释液)、稀释液3(改良的Modena稀释液)。
1.4 试验方法
1.4.1 试验设计
分别测定猪精液被试验前准备好的三种稀释液稀释后在常温条件下不同保存时间的精子活率、活力、运动参数、畸形率以及精液pH,本次试验的精液保存时间为5 d,每隔24 h进行一次测定,每组测定8次,对测定的数据进行整理,分析比较不同稀释液对常温保存下猪精液保存效果的影响,以求获得对猪精液常温保存效果最好的稀释粉。
1.4.2 猪精液的稀释和分组
将稀释液分为三组,用移液枪吸取1 mL的猪精液放置于离心管中,将稀释液用移液枪缓慢地加入到装有猪精液的离心管中进行稀释(每组稀释液做三个平行试样),稀释的比例为1:4,将离心管缓慢轻柔的晃动,使猪精液和稀释液充分混合,对离心管进行标记,将稀释后的猪精液放置于H5000B11型17℃恒温培养箱中保存,每隔12 h对猪精液摇晃一次,每隔24 h进行一次测定。
1.5 检测指标
1.5.1 精子的活率与活力
含有稀释液常温保存的猪精液的精子活率与活力用计算机辅助精子分析系统进行分析,从17℃恒温培养箱中将保存的猪精液取出,放在37℃二氧化碳培养箱中进行预热,预热5 min。将含有稀释液的猪精液缓慢晃动,直至没有沉淀为止,用移液枪吸取0.5 μL精液,放置于显微镜的载玻片上用盖玻片盖好(载玻片和盖玻片需要清洗干净,并用酒精擦拭一遍),调至适宜的位置与亮度,待精子在显示屏中清晰出现并且运动速度达到正常时对精液进行分析,得出精子的活率与活力,进行记录。
1.5.2 精子的运动参数
在猪精液保存过程中,用计算机辅助精子分析系统每24 h对猪精液的精子直线速度和路径速度进行检测,检测的具体步骤同1.5.1,得出猪精子的直线速度与路径速度,进行记录。
1.5.3 精子的畸形率
在猪精液保存过程中,用计算机辅助精子分析系统每24 h对猪精液的畸形率进行检测。
1.5.4 精液的pH
含有稀释液常温保存的猪精液的pH用精密pH计进行测量,将仪器深入到猪精液液面以下,进行测量,记录数据。
1.6 数据处理与统计分析
检测所得的数据用Microsoft Excel软件每天记录并整理,使用SPSS23.0数据分析软件对所得数据进行详细分析,将分析的数据运用邓肯进行方差分析和多重比较,分析比较出不同稀释液组的差异显著性(当P<0.05时表示差异性显著,当P>0.05表示差异性不显著),所得的数据均以“平均数±标准差”的形式进行表示。
2 结果
2.1 三种稀释液对猪精液精子活率、活力的影响
由表1可知,保存0 d时,三组稀释液精子活率差异均不显著(P>0.05);保存1 d时,2、3号稀释液组精子活率显著高于1号稀释液组(P<0.05),而2、3号稀释液组精子活率差异不显著(P>0.05);保存2~5 d时,3号稀释液组的精子活率显著高于1、2号稀释液组(P<0.05),同时2号稀释液组精子活率显著高于1号稀释液组(P<0.05)。
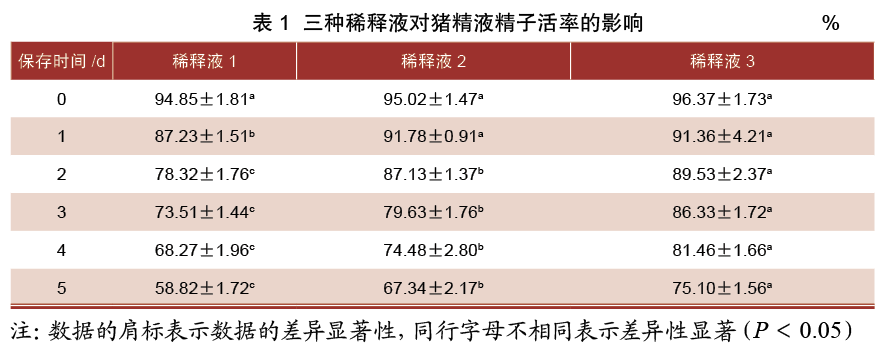
由表2可知,保存0 d时,三组稀释液精子活力差异均不显著(P>0.05);保存1~5 d时,3号稀释液组精子活力均显著高于1、2号稀释液组(P<0.05),同时2号稀释液组精子活力均显著高于1号稀释液组(P<0.05)。
2.2 三种稀释液对猪精液精子运动参数的影响
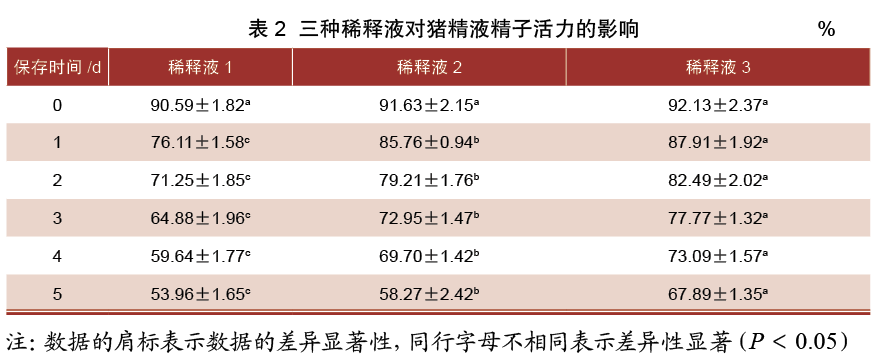
由表3可知,保存0 d时,三组稀释液精子直线速度差异均不显著(P>0.05);保存1~2 d时,3号稀释液组精子直线速度均显著高于1、2号稀释液组(P<0.05),同时2号稀释液组精子直线速度显著高于1号稀释液组(P<0.05);保存3~4 d时,2、3号稀释液组精子直线速度显著高于1号稀释液组(P<0.05),而2、3号稀释液组精子直线速度差异不显著(P>0.05);保存5 d时,3号稀释液组精子直线速度显著高于1、2号稀释液组(P<0.05),而1、2号稀释液组精子直线速度差异不显著(P>0.05)。
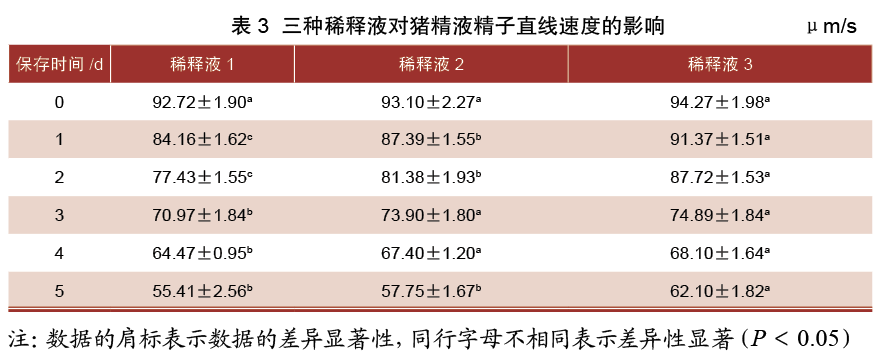
由表4可知,保存0 d时,三组稀释液精子路径速度差异均不显著(P>0.05);保存1~5 d时,3号稀释液组精子路径速度均显著高于1、2号稀释液组(P<0.05),同时2号稀释液组精子路径速度均显著高于1号稀释液组(P<0.05)。
2.3 三种稀释液对猪精液精子畸形率的影响
由表5可知,保存0 d时,三组稀释液精子畸形率差异均不显著(P>0.05);保存1 d时,1号稀释液组精子畸形率显著高于2、3号稀释液组(P<0.05),而2、3号稀释液组精子畸形率差异不显著(P>0.05);保存2 d时,1号稀释液组精子畸形率显著高于2、3号稀释液组(P<0.05),同时2号稀释液组精子畸形率显著高于3号稀释液组(P<0.05);保存3~4 d时,1、2号稀释液组精子畸形率显著高于3号稀释液组(P<0.05),而1、2号稀释液组精子畸形率差异不显著(P>0.05);保存5 d时,1号稀释液组精子畸形率显著高于2、3号稀释液组(P<0.05),同时2号稀释液组精子畸形率显著高于3号稀释液组(P<0.05)。
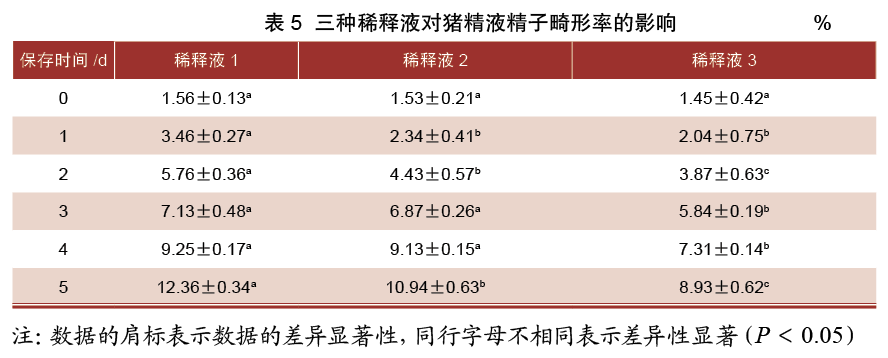
2.4 三种稀释液对猪精液pH的影响
由表6可知,保存0 d时,三组稀释液pH差异均不显著(P>0.05);保存1 d时,1号稀释液组pH显著高于2、3号稀释液组(P<0.05),而2、3号稀释液组pH差异不显著(P>0.05);保存2~3 d时,三组稀释液精液pH差异均不显著(P>0.05);保存4~5 d时,1、2号稀释液组pH显著高于3号稀释液组(P<0.05),而1、2号稀释液组pH差异不显著(P>0.05)。
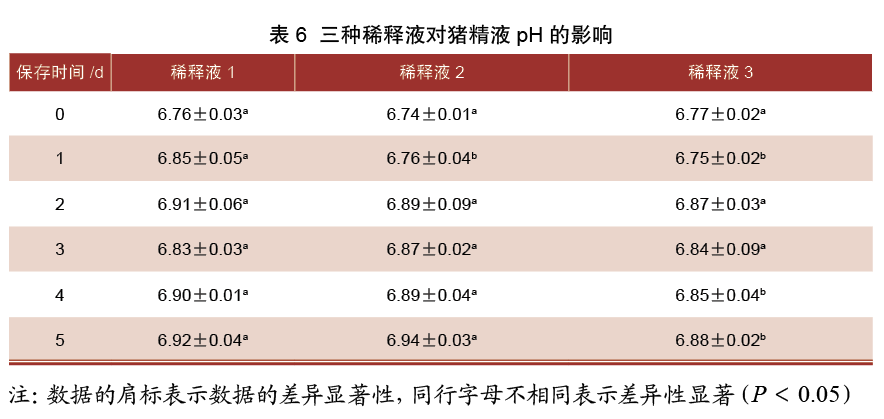
3 分析与讨论
精子活力和活率是评估精子质量的重要指标。根据国际标准要求精子活力需达到60%以上才能进行人工授精。稀释液中添加的抗氧化剂、营养素、激素和酶是影响猪精液常温保存的重要因素。本试验结果表明,试验第5天时添加2号稀释液和3号稀释液的精子活力均在60%以上。在保存2~5 d时,添加3号稀释液的精子活率显著高于2号(P<0.05),在保存0~5 d时,添加3号稀释液的精子活力显著高于2号(P<0.05)。综上所述,3号稀释液更适用于猪精液在常温下的保存,这可能是因为该精液稀释液中添加了葡萄糖、Tris等成分,洪洁赟的研究表明,适量的葡萄糖、Tris等在体外储存过程中具有猪精子供能、稳定精子结构、去除精子中的有害成分,从而提高猪精液保存的作用效果。
精子运动参数可间接反映精子活力。本试验对添加三种稀释液的精子直线速度、路径速度进行检测分析,结果表明,试验保存0~3 d和保存5 d时添加3号稀释液的精子直线速度显著高于添加1号和2号(P<0.05)。试验保存1~5 d时添加3号稀释液中精子路径速度显著高于添加1号和2号(P<0.05)。综上所述,3号稀释液更适用于猪精液常温保存。许多研究表明,精子在受精过程中会丢失大部分细胞质,使精子只会保留代谢物质和代谢能量的功能。而精子受精和精子运动的过程中都需要ATP的参与。因此稀释液的配方中会添加营养物质为精子供能。而3号稀释液添加的营养物质较其他两组稀释液更适合猪精液的常温保存。
畸形率是影响精子受精以及运动性的因素之一,人工受精时精子畸形率不能超过18%。试验结果显示,在相同温度和相同猪精液浓度的情况下,随着试验时间增加,添加三种稀释液的精子畸形率不断增加。试验2~5 d时添加3号稀释液后精子畸形率显著低于添加1号和2号(P<0.05),有研究表明,除环境温度和遗传因素外,某些化学物质以及细菌和病毒感染都会导致精子变形。在3种稀释液中,它的配方较其他两种显著缓解精子畸形率的增长,更适合猪精液的常温保存。
新鲜正常的猪精液pH大约在7.0~7.5之间。郭洪杞等人的研究发现,稀释液稀释后的猪精液pH保持在6.5~7.0之间,可有效延长精子的存活时间。本试验三种稀释液保存5 d的pH均在6.7~7.0左右,与郭洪杞等人的研究结果相近。其原因可能是在该pH条件下精子因稀释液产生的应激更小,更符合精子的生存环境。试验结果表明在第4天至5天时,添加3号稀释液的猪精液pH显著低于添加1、2号(P<0.05),pH分别为6.85和6.88。试验0~5 d时添加3号稀释液的猪精液pH的波动程度显著低于添加1、2号稀释液的猪精液(P<0.05)。综上所述,三种稀释液中3号稀释液的pH稳定性更高,可能因为是稀释液中会加入一些缓冲物质,在保护精子的同时延长精子的存活时间。而三种稀释液中3号稀释液的缓冲物质较另外两种稀释液的效果更好,更适合于猪精液的常温保存。
综合以上指标得出,三种稀释液组精子质量关系为:3号稀释液组>2号稀释液组>1号稀释液组,因此3号稀释液(改良版Modena稀释液)更适合于猪精液的常温保存。
















