摘要
轮状病毒(Rotavirus, RV) 可以感染猪、牛、犬猫等多种幼龄哺乳动物,引起腹泻,也可导致5岁以下儿童和婴幼儿感染急性胃肠炎,是一种重要的人畜共患病原体。但目前对不同宿主源轮状病毒相关研究较少,本研究以此为出发点,阐述当前轮状病毒在跨种属之间的传播途径,以及轮状病毒感染宿主基因重组过程。 1、引言
1973年,世人公认引起婴幼儿急性胃肠道炎的主要原因是感染RV。在此之前,已有研究显示在腹泻的小鼠、猴子和牛中发现RVS。后在猫、犬、蝙蝠和鸟类[1]等许多动物中均发现RV。儿童患病时如果病情处理不当,可能会导致严重脱水,最终引起死亡;动物感染轮状病毒会引起腹泻,影响生产率乃至经济发展。在过去的40余年中,已经积累了大量有关RV结构、复制周期、发病机理及其免疫应答的基础研究。随着现代诊断技术的进步,RV的分子流行病学得到广泛研究。迄今为止,RV已经从人类以及许多非人类的哺乳动物和鸟类中分离。 2、轮状病毒特性
2.1 RVA分子生物学特性RVA基因组的大小约为18500 bp,11个基因片段的长度在667bp和3302bp之间。RV进入宿主细胞是一个复杂的多步骤过程,其表面蛋白的不同结构域与不同的细胞表面分子相互作用。外部衣壳蛋白VP4和VP7在病毒复制和诱导保护性免疫中具有重要作用,诱导产生中和抗体,且在复制早期调节附着和渗透活动[2]。RV由胰蛋白酶切割VP4蛋白为VP5和VP8蛋白质而激活,与细胞膜上相应受体结合,可直接穿过细胞膜或被囊泡包裹进入细胞质。在穿膜期间或之后,外部衣壳蛋白去除,内壳的RdRp受刺激合成病毒mRNA,通过VP2和VP6蛋白层中的通道沿病毒粒子的顶点进入细胞质,翻译成病毒蛋白[3]。一旦其在细胞质内积累,形成内含物或病毒质,将启动新的病毒体前体的组装,组装完成的成熟病毒在粗面内质网腔内积聚,与NSP4跨膜糖蛋白结合,直到发生细胞裂解而释放。
2.2 RVA临床症状和发病机制
轮状病毒在鸟类和哺乳动物等多种宿主中引起无症状轻度水样腹泻,急性肠胃炎和脱水。症状发作突然,潜伏期为1~3天,该疾病的症状包括发烧,排尿减少,口干和咽干,站立时头晕,腹痛和呕吐2~3天,然后出现浅水状或松弛性非血性腹泻3~8天。此外,在发生急性肠胃炎期间经常出现呼吸道症状。病患主要通过粪便排出病毒感染他人[4]。其他基于血清学或直接病毒检测方法也表明,多种野生动物同样易感染轮状病毒。
猪轮状病毒( Porcine rotavirus, PoRV)感染通常发生在1~6周龄或8周龄以下的仔猪,且在小于60天或1周龄的猪中RVA的检出率最高。PoRV潜伏期为18~96h,引起腹泻和发烧。在特定的群中,RV的发病年龄通常一致。RVA排泄持续时间一般1d~14d,平均为7.4d,受被动免疫和血清群的影响。成年动物通常不会经常排泄病毒,但偶尔排泄病毒并成为感染源。
PoRV在没有与其他肠道病原体同时感染的情况下,哺乳期病猪的腹泻症状通常较轻,并且少于2~3天,排黄色或白色粪便,水样或絮状。发病率各有不同,但通常少于20%。尽管RV感染主要发生在小肠,但免疫能力弱的情况会导致RV向全身扩散。RV发病机制取决于宿主和病毒因素,并影响疾病的结果。影响RV临床结果的最明显宿主因素是年龄。由于在母体抗体经胎盘转移的保护作用下,小于或等于3个月的儿童感染轮状病毒很少患有症状性疾病,除免疫力低下的儿童外[5]。
不管与疾病相关的宿主或病毒因素如何,轮状病毒致腹泻能力均归因于两种不同的机制,包括NSP4引起的继发性吸收不良破坏肠上皮细胞及其吸收功能、绒毛局部缺血、肠毒素活性和细胞内液(钙离子和氯离子)分泌动员,及肠神经的激活和血管系统活化,即NSP4假说和肠道神经系统假说。此前,有研究发现在感染RV的早期NSP1通过激活细胞存活途径来抑制病毒诱导的细胞凋亡,对避免被抗原呈递细胞识别有一定作用,从而促进病毒的生长[6]。
3、RVA种间传播
3.1 动物源RVA的跨种间传播到人基因组进化是一个持续且缓慢的过程,但RV基因组分段的性质增强了进化过程,同时增强了病毒的遗传多样性。影响RV遗传多样性的其他因素包括基因内重组、点突变、种间传播和基因重排。
RV分段的基因组易发生重排(基因片段的交换),不同宿主源RV毒株的基因片段形成新基因型新毒株。最近,在各种动物中已经发现具有多种宿主起源的新基因型。从表面看,RV毒株跨宿种传播很难,但在获得宿主的基因组片段时,这些RV毒株在新的宿主种群中感染和传播的机会更高[7]。种间传播涉及将基因片段从一个物种转移到另一个物种。一个经典的例子是人类G9和G12基因型,由于猪基因转移到人类RV基因组中而在人群中传播[8]。图1-1所示的是在人类中发现的一些动物源RVA基因型的示意图。
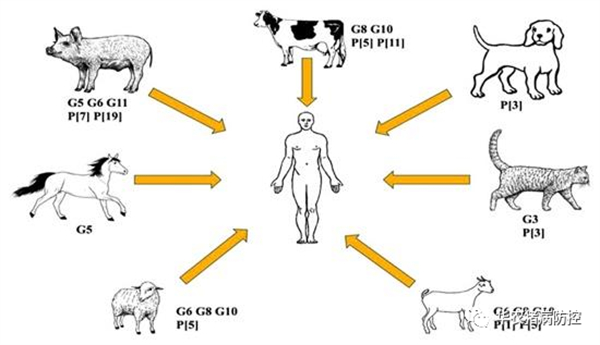
图1.1 HRV动物源基因型的示意图
重排是遗传多样性的主要原因,出现在同源或异源宿主之间,导致RV基因片段新基因型的出现。大多数人轮状病毒(Humanrotavirus,HRV)具有与经典HRV毒株Wa株(基因组1型基因)或DS-1 株(基因组2型基因)序列相似的基因[7]。Wa-like株包含I1-R1-C1-M1-A1-N1-T1-E1-H1的基因型,G/P基因型多为G1P[8]、G3P[8]、G4P[8]、G9P[8]、G12P[6]和G12P[8],而DS-1-like株的特征是包含I2-R2-C2-M 2-A2-N2-T2-E2-H2的基因型,G/P 基因型多为G2P[4][9]。有研究表明新基因型G2P[8]、G9P[8]、G9P[4]、G9P[6]和G12P[6]就是通过重配而出现[10]。例如非洲地区分离到的G4P[6]和G9P[13]毒株的基因组片段中含有亚洲国家的人和猪RVA毒株的基因片段[11]。PoRV和HRV Wa-like株之间发生重配,在人体内检测到G11基因型;牛轮状病毒(Bovine rotavirus, BRV)和HRV之间的重配产生G8基因型[12],揭示了HRV Wa -like株和PoRV毒株之间有共同起源,HRV DS-1-ike株和BRV之间有共同起源。有研究表明,这种物种间传播和动物—人的重配事件可以来自很多物种之间,各种动物物种如偶蹄动物(反刍动物和骆驼科动物)、猫、狗、猪、兔子、甚至野生动物(猴子)等[12]。Nakagomi从一名饲养猫的小孩体内分离到RVG3株(AU228),几乎所有基因片段都与猫轮状病毒(Feline rotavirus, FRV)毒株(FRV-1)的基因型相同。以色列一饲养犬的家庭中,其三周大的婴儿被RV G3毒株感染[13]。人类和动物轮状病毒之间紧密的进化联系强调了对动物和人类中的RV进行密切同步监测的必要性。
目前来看,动物源RVA跨种间传播到人的机制尚不清楚。所有观察到的跨种传播事件均归因于基因组测序。通过对11个基因片段的全部或部分测序结果进行分析,是一种用于获取RVA毒株起源精确信息的一种可靠方法,并可以追踪其进化模式。跨种间传播有三种形式: 一种是RVA毒株没有经过基因重配,而是直接跨种间传播给人类;另一种是RVA毒株某些基因片段和HRVA毒株发生基因重排,导致其跨物种传播给人类;第三是该RVA毒株通过与HRVA毒株和其他动物RVA毒株通过多次基因重排的发生而感染人类,从而产生了新型的RVA毒株。
3.2 跨种间传播的途径
RVA的种间传播被认为是轮状病毒进化的重要因素,促成人类和动物中RVA的多样性。轮状病毒进化的机制包括点突变、种间传播、基因重排以及基因重组,基因组进化可能发生在基因组内部或基因组间,种间传播和不同物种的RVA之间发生重配可以导致新型轮状病毒株的出现和传播[14]。以下将介绍动物轮状病毒可能传播给人类的途径。
一是直接接触动物,包括养殖场和家养动物。在许多发展中国家,人类与家畜之间有着密切的联系。在容易发生洪水或季风气候的地区,会增加与动物粪便接触的机会。在养殖场中,就养殖员与动物的比例而言,虽然他们的接触相对有限,但这种接触足以使动物RV毒株或RV基因片段进入人群。除粪便外,灰尘和污水可能是RV在动物和养殖员之间以及向其他可以进入农场的人传播的潜在媒介。养殖员工衣服和鞋类可能被污染,然后在洗澡后头发和皮肤上的RV不易被清除,在他们离开养殖场后,会让接触的其他人暴露于RV,导致感染。在日常生活中,人们通过与家养宠物,特别是与猫狗的接触,也可以导致人类接触动物RV并造成感染。
二是环境污染。被感染的牛,猪和羊的粪便中含有大量的感染性RV颗粒,这是一种潜在污染源。在农村地区,沉积在田间粪便中的病毒可能通过径流水进入淡水,例如河流或湖泊。同样,牛和猪的排泄物可以贮存,很可能会通过粪肥或粪便污染耕地,水源,甚至还可能污染农作物。食用污染的食物也有可能造成RV的感染。有几种肠病毒已被证明可通过水传播,并且水已成为全世界RV暴发的媒介。有研究在有儿童患轮状病毒病的家庭中的饮用水中检测到BRV和PoRV(A组,但未报告基因型)。
三是空气污染。许多病毒感染可以通过空气传播,RV可在空气中传播引起小鼠腹泻,证明RV的空气传播途径,但在猪群中这不是主要传播途径。
3.3 猪RVA传播到人
目前,猪源RVA毒株的G型如G1-G5,G9-G12,G24和G26,P型如P[4]、P[6]、P[8]、P[13]、P[14]、P[19]、P[23]和P[25],已在人上检测到。其中,G9和G12型的RVA毒株在世界各地的人群中大范围流行。
在泰国发现2株人源G4P[6]RVA毒株具有猪源RVA毒株的基因组特征,1株为I1VP6基因型,1株为I5VP6基因型。由于该地区已发现具有I5VP6基因型的猪源RVA毒株,所以基因型为I1的猪源RVA毒株可能通过自然界与具有I5基因型的猪源RVA毒株之间的发生重配获得I5基因型,后跨种传播到人,印证以下假设猪在新型猪RVA跨种传播到人的传播中作为重要的来源或起着贮藏的作用[15]。
在G9毒株中,G9P[6]毒株被鉴定为猪—人重组毒株,而G9P[19]毒株是人畜共患猪源毒株[16]。在印度发现人源G9P[19]RVA毒株测序成功的8个基因中有7个具有猪源RVA基因组特征,其中VP1、VP2和VP3基因与猪源轮状病毒株有密切遗传关系,VP7是该毒株与人类毒株具显著遗传同一性的唯一基因片段。这表明该轮状病毒重配株的大部分遗传物质都来自猪源RV毒株,并可以在人类宿主中引起有症状感染[17]。
泰国1株基因型为G9P[23]的HRV毒株的系统发育分析表明,所有11 个基因都为猪源[18],在泰国同一时间和地理区域内也发现基因型均为G9P[19]的人和猪RVA毒株[19],且在中国四川省某猪场饲养员及猪粪便中分离到的RVA毒株具有相同G3P[13]基因型,都对猪RVA的跨种间传播提供了证据[20]。
3.4 猫和犬RVA传播到人
通过全基因组分析发现人源G3P[3]株是人畜共患的犬/猫毒株[21],表明Ro1845和HCR3A毒株由犬/猫轮状病毒直接跨种传播到人,对这2株HRV毒株及基因型为G3P[3]的3株犬轮状病毒(Caninerotavirus,CRV)毒株CU-1、K9和A79-10以及2株FRV毒株Cat97、Cat2 进行序列分析,在分子水平上进一步表征这2株人源毒株与犬猫毒株的关系,表明犬和猫RVA跨种间传播到人的现象存在。
以下毒株的重排现象也说明猫和犬RVA可跨种间传播到人犬/猫和AU-1-like的人源毒株,2株基因型为G3P[3] CRV毒株RV198-95和RV52-96的VP1和VP2片段与HRV毒株AU-1亲缘关系较近[22];犬/猫和Wa-like的人源毒株;犬/猫、Wa-like人源毒株和DS-1-like人源/牛源毒株。
3.5 牛RVA传播到人
1株分离自腹泻儿童的偶蹄动物源G10P[14]毒株,印证牛RVA可以跨种间传播到人[7]。对人源G6P[6]株毒株RV AHuman-wt/BEL/B1711/2002/G6P[6]的全部基因组分析揭示了在人源DS-1-like遗传骨架上有牛源VP3和VP7基因[12]。非洲的G8P[6]和G8P[8]毒株也表现出复杂的进化模式,涉及到DS-1-like毒株、Wa-like毒株、携带P[6]基因型的RVA毒株和牛源毒株的多重重排现象。而人源G6P[14]和G8P[14]RVA毒株也是人畜共患的偶蹄动物毒株[10]。对德国1株基因型为G8P[4]的GER1H-09毒株进行全基因组测序分析显示牛G8和DS-1-like人源G2P[4]毒株之间存在重配事件。
4、讨论与总结
1994年以来至2013年,在中国 RV 的流行病学和临床研究中最常报道就是G1/G 3/G9P[8]和G2P[4]。自2012年以来在武汉G9P[8]已成为儿童和成人中 HRV 最常见的基因型组合,并且一直占主导地位。从全球范围内来看,RV毒株的 G9 型于1990年代中期就已出现在人类中,有研究认为其最有可能来源于猪,因为猪是已知唯一受此基因型感染的物种。从当前的研究文献来看,猪轮状病毒毒株在全球范围内,发生了重组及跨种间传播的证据,其对养猪行业以及人类公共卫生的重要意义值得进一步深究和探讨。















