近2年多来,受非瘟的影响,我国猪群的结构发生了很大变化,后备母猪大量入群,三元母猪占比较高,引种日龄偏大,没有足够的隔离、免疫驯化时间,导致猪群疫病越来越复杂,母猪繁殖障碍明显增多。猪细小病毒病是重要的常见繁殖障碍性疾病,该病由猪细小病毒(PPV)引起,主要危害初产母猪及血清学阴性经产母猪,临床表现为流产、死胎、畸形胎、木乃伊胎、弱仔、发情不正常、久配不孕等繁殖障碍,而母猪本身无明显其他临床症状。此外,猪细小病毒还可能在腹泻、皮炎以及呼吸道疾病中扮演一定角色,与猪繁殖与呼吸综合征病毒、猪圆环病毒2型等常见病毒混合感染现象较为普遍,给养猪业造成更大损失。
1 危害及临床表现
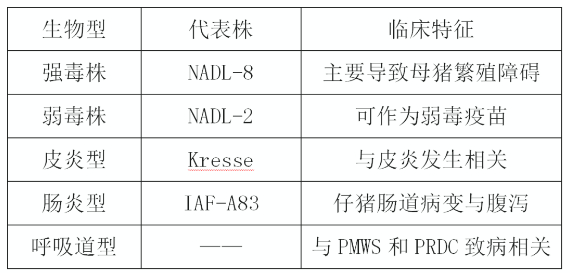
猪细小病毒病只有一个血清型,迄今为止,共发现 7 种猪细小病毒,分别为猪细小病毒 1-7 型。不同的毒株致病性和临床表现有所不同,可分为以下5种。
1 危害及临床表现
猪细小病毒病只有一个血清型,迄今为止,共发现 7 种猪细小病毒,分别为猪细小病毒 1-7 型。不同的毒株致病性和临床表现有所不同,可分为以下5种。
1.1 母猪繁殖障碍
母猪繁殖障碍的临床表现和感染时所处的妊娠阶段有关。PPV感染母猪以后,往往需要10~14天才能由子宫感染胚胎或胎儿。如果胚胎在受精后6天内感染PPV,PPV没有能力突破透明带的保护,胚胎将不受影响;胚胎在妊娠6~35天感染,胚胎将死亡并被母体吸收, 造成母猪不孕或不规则返情;35~70天感染,主要是产木乃伊胎、死胎;妊娠70天感染,则多能正常产仔,但弱仔比例升高,这些仔猪常常有抗体和病毒。PPV感染胎儿为逐个、缓慢进行,有时出现不同大小的木乃伊、弱仔、活仔共存的现象。如果公猪被感染,性欲和受精率无明显影响,但精液可长期排毒。

一般情况下,感染本病的母猪死亡率不高,主要影响胎儿。剖检可见其子宫内膜有炎症征兆,炎症一般比较轻微,有时胎盘出现部分钙化。同窝死胎大小不一;有木乃伊胎,畸形,骨质溶解的腐败化胎儿;多数死胎、死仔或弱仔皮肤、皮下充血或水肿,胸、腹腔积液,有淡红色或淡黄色渗出液。肝、脾、肾有时肿大脆弱或者萎缩发暗。
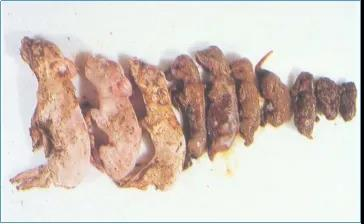
早期死亡胎儿成木乃伊,后期感染胎儿发育完整、流产
1.2 皮炎型表现
猪细小病毒的某些毒株(如Kresse株),可以导致仔猪皮肤炎症,临床表现为厌食、腹泻和结膜炎,被感染猪拱嘴、舌和蹄部的皮肤出现病变,受伤皮肤处确实存在PPV的复制。J. Kim等(2004)还从渗出性皮炎的回顾性研究中发现PCV2和PPV的共感染现象。
1.3 肠炎型表现
加拿大魁北克省某猪场大批仔猪出现腹泻症状,仔猪大小集中在2-3周龄。病猪排泄量大、粪便形式为水样或黄痢,持续时间一般为1周,无呕吐现象,并且保持很好的食欲。经检测分析证明PPV与仔猪腹泻有一定关联。韩国Chea(2011)认为感染PPV的仔猪会发生免疫抑制而增加对PEDV的敏感性;在韩国的PED地方性流行场中,PEDV和PPV的共感染率高达46.6%。
2 猪细小病毒流行特点
2.1 易感宿主
猪是唯一已知宿主,不同年龄、性别的家猪、野猪都可感染。
2.2 传染源
病猪和带毒猪是主要的传染源。猪在感染细小病毒后3-7日开始排出病毒、污染环境。感染母猪所产的死胎、活胎、仔猪及子宫分泌物中均含有大量病毒;子宫内感染的仔猪至少可带毒9周以上;有些具有免疫耐性的仔猪可终生带毒和排毒。被感染的公猪,其精细胞、精索、附睾和副性腺均含有病毒,在其配种时很易传给易感母猪,常引起本病的扩大传播。细小病毒对外界环境的抵抗力很强,可在被污染的猪舍生存数月之久,如果消毒不到位,易造成长期连续传播。
2.3 传播途径
本病可经胎盘垂直感染和交配感染。也可通过被污染的食物、环境,经呼吸道、消化道感染。另外,鼠类也可传播本病。
2.4 流行形式
未免疫母猪群或者免疫失败的母猪群中,细小病毒病会大面积爆发并引起流产,并且在猪群中存在的时间比较长。免疫母猪群出现繁殖损失的情况比较少。一般呈地方流行性或散发,无明显的季节性。
2.5 广泛流行
该病呈全球分布,国内猪群中已流行广泛,且在个别地区感染率较高。吴家俊(2017)报道,中国动物疫病预防控制中心对全国近 100 家重点原种猪场(2011年-2016年)及19 家种公猪站(2016年)进行了监测,结果表明猪细小病毒感染较为严重。一是污染面大,场阳性率常年维持在 82.0% 以上;二是个体感染情况较严重,2016 年个体阳性率达 33.6%;三是流行毒株类型多,45 个阳性猪场部分基因测序结果显示,毒株类型涵盖猪细小病毒 5 个主要亚群中的 3 个,包含了国内所有病毒亚群。孙久萌(2019年)对我国30个省、市、自治区的437份(1990-1999年200 份,2011-2017你那237 份)临床组织样品进行了PPV1-7 的特异性 PCR 检测,检测结果显示:58.1%(254/437)的样品至少存在 1 种细小病毒感染,样品检测阳性率从高到低依次为 PPV6(31.1%)、PPV2(28.4%)、PPV3(22.2%)、PPV7(13.5%)、PPV4(11.4%)、PPV5(5.9%)和 PPV1(5.0%)。段群鹏(2019年)对2014-2017年在广西收集的340份流产胎儿样品的病原学检测结果,PPV场阳性率6%(6/100),样品阳性率为2.35%(8/340)。吴海超(2014)等对湖南某规模化猪场的214 份猪血清进行猪细小病毒病原检测,结果发现15、16、17、18、22 周龄均检测到该病毒,检测阳性率依次为10%、40%、20%、15.4%、9%。孙泉云(2018)等从3个生猪屠宰场1879份上市肉猪的颌下淋巴结、扁桃体样品中检出PPV 阳性671 份,阳性率35.71%,说明猪群PPV感染非常普遍。
2.6 混合感染增多
S. Kennedy等(2000)研究证实,仔猪单纯感染PCV2能导致PMWS,但是临床比例低而且发病温和,然而双重感染PCV2和PPV的仔猪发生PMWS的机会要高得多,临床问题也严重得多,肺、淋巴、肝脏等器官的病变更严重,PCV2在这些器官中的含量明显更高,说明PPV促进了PCV2的繁殖和病变表现。此外,PPV与猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、圆环病毒2型(PCV2)和繁殖与呼吸综合征病毒(PRRSV)的混合感染情况也比较常见。
3 诊断
3.1 一般认为,母猪发生流产、死胎、木乃伊胎和胎儿发育异常等繁殖障碍;同窝中死亡胎儿大小不一;初产母猪高发,胎龄越低,发病率越高;但母猪食欲、精神状态等各方面无其他异常,则重点怀疑有猪细小病毒的可能。猪伪狂犬病、乙型脑炎、繁殖与呼吸综合征、猪瘟、钩端螺旋体、衣原体病和布鲁氏菌病等也可引起流产和死胎,应注意与本病的鉴别。
3.2 病原学检测:病毒分离鉴定是检测抗原最确实的方法。猪细小病毒的分离主要取70日龄以内的流产胎儿、死产仔猪肾脏、肝脏及肠系膜淋巴结。PCR或荧光PCR快速、敏感,是目前常用的检测方法。
3.3 猪细小病毒抗体检测常用方法有血凝抑制试验(HI)、乳胶凝集试验和酶联免疫吸附试验(ELISA)等。
4 国内批准使用的猪细小病毒疫苗
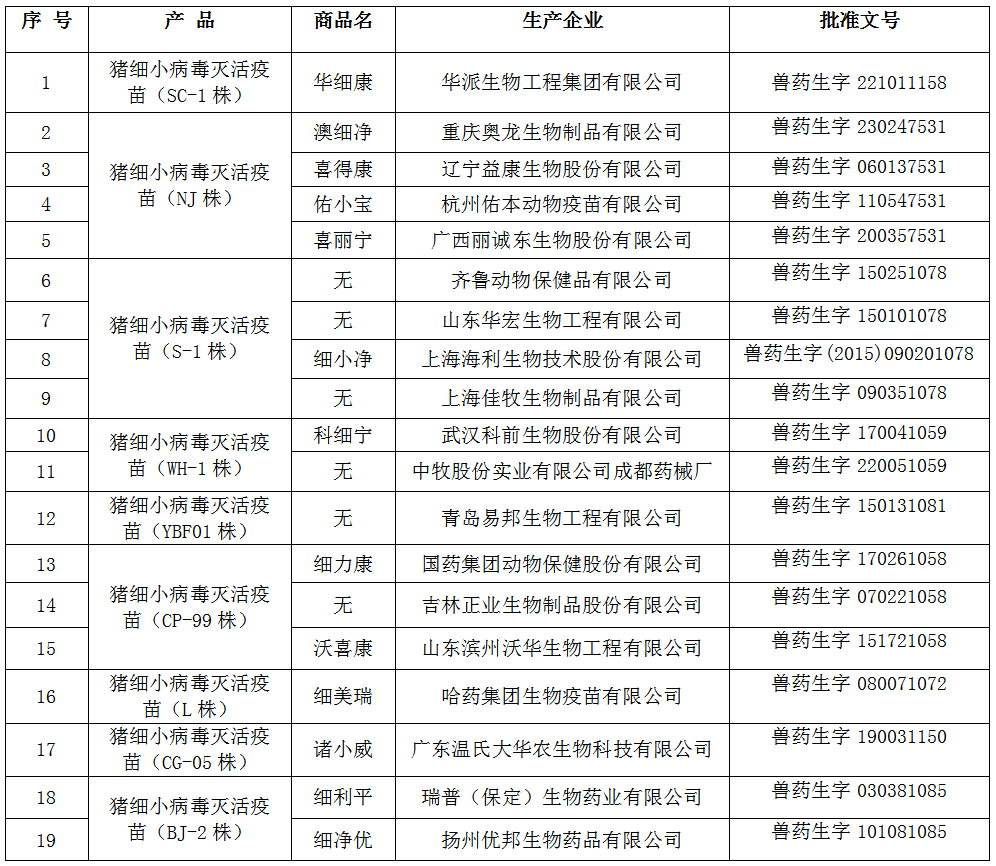
截止2021年3月31日,国内在有效期内的猪细小病毒灭活疫苗批准文号共9个毒株19家企业。
1.2 皮炎型表现
猪细小病毒的某些毒株(如Kresse株),可以导致仔猪皮肤炎症,临床表现为厌食、腹泻和结膜炎,被感染猪拱嘴、舌和蹄部的皮肤出现病变,受伤皮肤处确实存在PPV的复制。J. Kim等(2004)还从渗出性皮炎的回顾性研究中发现PCV2和PPV的共感染现象。
1.3 肠炎型表现
加拿大魁北克省某猪场大批仔猪出现腹泻症状,仔猪大小集中在2-3周龄。病猪排泄量大、粪便形式为水样或黄痢,持续时间一般为1周,无呕吐现象,并且保持很好的食欲。经检测分析证明PPV与仔猪腹泻有一定关联。韩国Chea(2011)认为感染PPV的仔猪会发生免疫抑制而增加对PEDV的敏感性;在韩国的PED地方性流行场中,PEDV和PPV的共感染率高达46.6%。
2 猪细小病毒流行特点
2.1 易感宿主
猪是唯一已知宿主,不同年龄、性别的家猪、野猪都可感染。
2.2 传染源
病猪和带毒猪是主要的传染源。猪在感染细小病毒后3-7日开始排出病毒、污染环境。感染母猪所产的死胎、活胎、仔猪及子宫分泌物中均含有大量病毒;子宫内感染的仔猪至少可带毒9周以上;有些具有免疫耐性的仔猪可终生带毒和排毒。被感染的公猪,其精细胞、精索、附睾和副性腺均含有病毒,在其配种时很易传给易感母猪,常引起本病的扩大传播。细小病毒对外界环境的抵抗力很强,可在被污染的猪舍生存数月之久,如果消毒不到位,易造成长期连续传播。
2.3 传播途径
本病可经胎盘垂直感染和交配感染。也可通过被污染的食物、环境,经呼吸道、消化道感染。另外,鼠类也可传播本病。
2.4 流行形式
未免疫母猪群或者免疫失败的母猪群中,细小病毒病会大面积爆发并引起流产,并且在猪群中存在的时间比较长。免疫母猪群出现繁殖损失的情况比较少。一般呈地方流行性或散发,无明显的季节性。
2.5 广泛流行
该病呈全球分布,国内猪群中已流行广泛,且在个别地区感染率较高。吴家俊(2017)报道,中国动物疫病预防控制中心对全国近 100 家重点原种猪场(2011年-2016年)及19 家种公猪站(2016年)进行了监测,结果表明猪细小病毒感染较为严重。一是污染面大,场阳性率常年维持在 82.0% 以上;二是个体感染情况较严重,2016 年个体阳性率达 33.6%;三是流行毒株类型多,45 个阳性猪场部分基因测序结果显示,毒株类型涵盖猪细小病毒 5 个主要亚群中的 3 个,包含了国内所有病毒亚群。孙久萌(2019年)对我国30个省、市、自治区的437份(1990-1999年200 份,2011-2017你那237 份)临床组织样品进行了PPV1-7 的特异性 PCR 检测,检测结果显示:58.1%(254/437)的样品至少存在 1 种细小病毒感染,样品检测阳性率从高到低依次为 PPV6(31.1%)、PPV2(28.4%)、PPV3(22.2%)、PPV7(13.5%)、PPV4(11.4%)、PPV5(5.9%)和 PPV1(5.0%)。段群鹏(2019年)对2014-2017年在广西收集的340份流产胎儿样品的病原学检测结果,PPV场阳性率6%(6/100),样品阳性率为2.35%(8/340)。吴海超(2014)等对湖南某规模化猪场的214 份猪血清进行猪细小病毒病原检测,结果发现15、16、17、18、22 周龄均检测到该病毒,检测阳性率依次为10%、40%、20%、15.4%、9%。孙泉云(2018)等从3个生猪屠宰场1879份上市肉猪的颌下淋巴结、扁桃体样品中检出PPV 阳性671 份,阳性率35.71%,说明猪群PPV感染非常普遍。
2.6 混合感染增多
S. Kennedy等(2000)研究证实,仔猪单纯感染PCV2能导致PMWS,但是临床比例低而且发病温和,然而双重感染PCV2和PPV的仔猪发生PMWS的机会要高得多,临床问题也严重得多,肺、淋巴、肝脏等器官的病变更严重,PCV2在这些器官中的含量明显更高,说明PPV促进了PCV2的繁殖和病变表现。此外,PPV与猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、圆环病毒2型(PCV2)和繁殖与呼吸综合征病毒(PRRSV)的混合感染情况也比较常见。
3 诊断
3.1 一般认为,母猪发生流产、死胎、木乃伊胎和胎儿发育异常等繁殖障碍;同窝中死亡胎儿大小不一;初产母猪高发,胎龄越低,发病率越高;但母猪食欲、精神状态等各方面无其他异常,则重点怀疑有猪细小病毒的可能。猪伪狂犬病、乙型脑炎、繁殖与呼吸综合征、猪瘟、钩端螺旋体、衣原体病和布鲁氏菌病等也可引起流产和死胎,应注意与本病的鉴别。
3.2 病原学检测:病毒分离鉴定是检测抗原最确实的方法。猪细小病毒的分离主要取70日龄以内的流产胎儿、死产仔猪肾脏、肝脏及肠系膜淋巴结。PCR或荧光PCR快速、敏感,是目前常用的检测方法。
3.3 猪细小病毒抗体检测常用方法有血凝抑制试验(HI)、乳胶凝集试验和酶联免疫吸附试验(ELISA)等。
4 国内批准使用的猪细小病毒疫苗
截止2021年3月31日,国内在有效期内的猪细小病毒灭活疫苗批准文号共9个毒株19家企业。
5 猪细小病毒病综合防控
猪细小病毒抵抗力强,对该病的防控必须采取综合防控方案。
5.1 科学引种
引种往往是导致细小病毒发病的重要原因。如要引进种猪,需从管理规范,疫病防控确实的猪场引种,引进种猪需隔离观察和检疫,并做好免疫和驯化后方可入场混养。来自木乃伊窝的仔猪,可能是本病毒的携带者,不能做种用,也不要在头胎母猪的后代中选留种猪。
5.2 免疫接种
目前对易感猪进行免疫,是最有效的防控措施。后备种猪在5-6月首免,2-4周后再加强免疫1次;成年公猪每年接种2次;经产母猪产后2周接种1次。
原来对细小病毒的防疫主要集中在后备母猪或头二胎防疫。研究表明,猪细小病毒不仅影响母猪的繁殖性能,也会影响仔猪的抵抗力;此外,由于非瘟的影响很多猪场临时决定采用三元母猪扩繁,增加了细小感染的压力。如果配种前没有做好细小的免疫,常常造成繁殖障碍,并增加场区病原的浓度。因此,当前建议所有的经产母猪都产后14天免疫一次,感染压力大的场,后备种猪(特别是三元母猪)初次选育合格时进行细小病毒疫苗免疫,配种前再免疫2次。
5.3 做好生物安全管理
做好场外生物安全防止病原传入,同时做好场内生物安全,防止交叉感染。特别是已污染的猪舍要严格清扫消毒。
5.4 检测淘汰
做好公猪和精液的检测,淘汰阳性公猪。
猪细小病毒抵抗力强,对该病的防控必须采取综合防控方案。
5.1 科学引种
引种往往是导致细小病毒发病的重要原因。如要引进种猪,需从管理规范,疫病防控确实的猪场引种,引进种猪需隔离观察和检疫,并做好免疫和驯化后方可入场混养。来自木乃伊窝的仔猪,可能是本病毒的携带者,不能做种用,也不要在头胎母猪的后代中选留种猪。
5.2 免疫接种
目前对易感猪进行免疫,是最有效的防控措施。后备种猪在5-6月首免,2-4周后再加强免疫1次;成年公猪每年接种2次;经产母猪产后2周接种1次。
原来对细小病毒的防疫主要集中在后备母猪或头二胎防疫。研究表明,猪细小病毒不仅影响母猪的繁殖性能,也会影响仔猪的抵抗力;此外,由于非瘟的影响很多猪场临时决定采用三元母猪扩繁,增加了细小感染的压力。如果配种前没有做好细小的免疫,常常造成繁殖障碍,并增加场区病原的浓度。因此,当前建议所有的经产母猪都产后14天免疫一次,感染压力大的场,后备种猪(特别是三元母猪)初次选育合格时进行细小病毒疫苗免疫,配种前再免疫2次。
5.3 做好生物安全管理
做好场外生物安全防止病原传入,同时做好场内生物安全,防止交叉感染。特别是已污染的猪舍要严格清扫消毒。
5.4 检测淘汰
做好公猪和精液的检测,淘汰阳性公猪。
















