非洲猪瘟之所以能做到精准剔除的理论基础主要有三点:
1、非洲猪瘟的传播速度非常慢,为我们清除感染猪只提供了时间;
2、非洲猪瘟的感染静默期比潜伏期长,刚刚出现临床症状的猪只并没有向外排毒,我们可以在感染猪只向外排毒前清除;
3、可以通过检测口腔拭子,在猪只出现临床症状前确认感染猪只,从而把处于潜伏期感染的猪只清除。
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(ASF virus,ASFV)感染引起的猪的一种急性、热性、高度接触性传染病,发病率和死亡率可高达100%,是世界动物卫生组织(OIE)法定报告的动物疫病,我国将其列为一类动物疫病。因为目前尚无有效的疫苗预防,一旦发生非洲猪瘟疫情会给当地养猪生产造成巨大经济损失。但是ASFV仅感染家猪、野猪以及软蜱,不感染人,对人类健康无影响。
1921年东非国家肯尼亚首次确认非洲猪瘟疫情,之后在1957年传入欧洲,1971年传入美洲(古巴、巴西、多米尼加以及海地等),2007年从东非传播至欧亚接壤的格鲁吉亚,并迅速传入东欧和中欧。2018年8月3日,我国确诊第一起发生于辽宁省沈阳市沈北新区的非洲猪瘟疫情,随后国内各省份陆续报道了非洲猪瘟疫情。
01、非洲猪瘟病原学
非洲猪瘟病毒是一个复杂的二十面体DNA病毒(图1-1),是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,病毒基因组的长度从170kb到193kb不等,包含150~167个开放阅读框,其编码的大部分蛋白质功能并不十分清楚。基于p72基因的部分核酸序列,ASFV可分为24种基因型,步志高等人分离、鉴定了我国第一株非洲猪瘟病毒(Pig/HLJ/18),该流行毒株基于基因p72分型属于基因Ⅱ型,血清8群。研究结果证实,我国此次流行的ASFV毒株能引起感染猪只高度急性病程,具有高度的致病性和致死率。
1、非洲猪瘟的传播速度非常慢,为我们清除感染猪只提供了时间;
2、非洲猪瘟的感染静默期比潜伏期长,刚刚出现临床症状的猪只并没有向外排毒,我们可以在感染猪只向外排毒前清除;
3、可以通过检测口腔拭子,在猪只出现临床症状前确认感染猪只,从而把处于潜伏期感染的猪只清除。
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(ASF virus,ASFV)感染引起的猪的一种急性、热性、高度接触性传染病,发病率和死亡率可高达100%,是世界动物卫生组织(OIE)法定报告的动物疫病,我国将其列为一类动物疫病。因为目前尚无有效的疫苗预防,一旦发生非洲猪瘟疫情会给当地养猪生产造成巨大经济损失。但是ASFV仅感染家猪、野猪以及软蜱,不感染人,对人类健康无影响。
1921年东非国家肯尼亚首次确认非洲猪瘟疫情,之后在1957年传入欧洲,1971年传入美洲(古巴、巴西、多米尼加以及海地等),2007年从东非传播至欧亚接壤的格鲁吉亚,并迅速传入东欧和中欧。2018年8月3日,我国确诊第一起发生于辽宁省沈阳市沈北新区的非洲猪瘟疫情,随后国内各省份陆续报道了非洲猪瘟疫情。
01、非洲猪瘟病原学
非洲猪瘟病毒是一个复杂的二十面体DNA病毒(图1-1),是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,病毒基因组的长度从170kb到193kb不等,包含150~167个开放阅读框,其编码的大部分蛋白质功能并不十分清楚。基于p72基因的部分核酸序列,ASFV可分为24种基因型,步志高等人分离、鉴定了我国第一株非洲猪瘟病毒(Pig/HLJ/18),该流行毒株基于基因p72分型属于基因Ⅱ型,血清8群。研究结果证实,我国此次流行的ASFV毒株能引起感染猪只高度急性病程,具有高度的致病性和致死率。
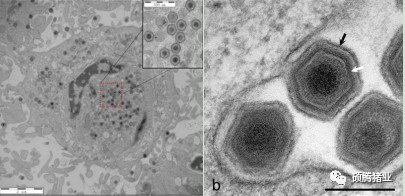
图1-1 电镜下非洲猪瘟病毒粒子
02、非洲猪瘟传染源及传播途径
猪是非洲猪瘟病毒唯一的自然宿主,除家猪和野猪外,其它动物不感染该病毒。欧洲野猪比较容易被病毒感染,表现出的症状跟家猪相似,但有三种非洲野猪 (疣猪、大林猪、非洲野猪) 不表现出症状,呈隐性带毒,成为病毒的贮存器。发病猪和带毒猪是非洲猪瘟病毒的主要传播源,病猪各组织器官、体液、各种分泌物、排泄物中均含有高滴度的病毒,因此可经病猪的唾液、鼻分泌物、泪液、尿液、粪便、生殖道分泌物以及破溃的皮肤、病猪血液等进行传播。同时,康复猪能保持高抗体水平和长时间的病毒血症,而且病毒能在组织中存活数周至数月。因此,一旦感染过ASFV的家猪存活下来,带毒家猪就会变成该病重要的传染源。非洲猪瘟病毒是唯一的虫媒DNA病毒,软蜱是主要的传播媒介和贮存宿主,多种软蜱,包括非洲钝缘蜱和伊比利亚半岛的游走钝缘蜱,都是ASFV的携带者和传播者。
非洲猪瘟病毒的传播途径主要有三种模式:直接接触传播、间接接触传播以及媒介传播。1、直接接触传播:感染动物通过带毒的唾液、呼吸道分泌物、尿液和粪便等直接接触感染健康动物;2、间接接触传播:ASFV通过污染物间接传播,比如未煮熟的含ASFV的潲水,ASFV污染的拉猪车、水源、饲料,接触过ASFV的人员、老鼠、蝇蚊等;3、媒介传播:感染ASFV的软蜱作为媒介在吸血时将ASFV传播给猪、其它蜱及其后代。非洲猪瘟自去年传入我国辽宁以后,以非常迅速的速度传遍全国,我们根据行业会议的数据,统计分析了30个发生过非洲猪瘟疫情的猪场的传播途径(图1-2),发现其中ASFV污染的车辆(约为23.08%)、卖淘汰猪(约为15.38%)、卖育肥猪(约为11.54%)、ASFV污染的饲料(约为11.54%)等是主要的传播途径。
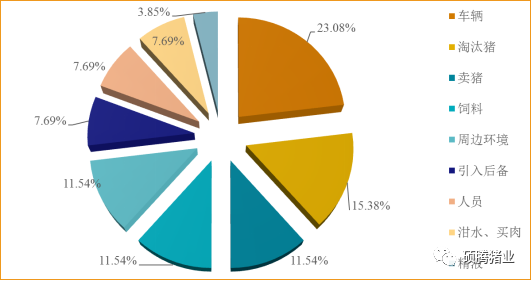
图1-2 非洲猪瘟在我国的主要传播途径
03、非洲猪瘟病毒的传染性
首先我们需要明确的是:一个病原的传染性与该病原感染引起疾病的发病程度以及该疾病的影响并不相关,一个低传染性的病原感染后可能引起非常严重的疾病,而一个高传染性的病原感染后可能只是引起轻微发病。非洲猪瘟病毒属于典型的低传染性、高致死率的病毒。
Depner等研究表明:相对于口蹄疫病毒、猪瘟病毒来讲,非洲猪瘟病毒的传染性属于低传染性病原。因为如果将99头未感染病毒猪与1头已感染病毒猪混养,对于口蹄疫病毒来说,那么所有的猪都会被感染,但是只有2头猪死亡,因此口蹄疫病毒属于高传染性病原;而对于非洲猪瘟病毒来讲,99头猪中只会有9头被感染,但是这9头被感染的猪会全部死亡,说明非洲猪瘟病毒的传染性很低,但是致死率很高(如图1-3)。
因此,从理论上讲,在排除外界干扰的情况下(因人员、猪只流动等因素导致非洲猪瘟疫情传播加快),非洲猪瘟的传播速度非常慢,这也为猪场实施精准剔除(俗称“拔牙”)时间上的可能性。
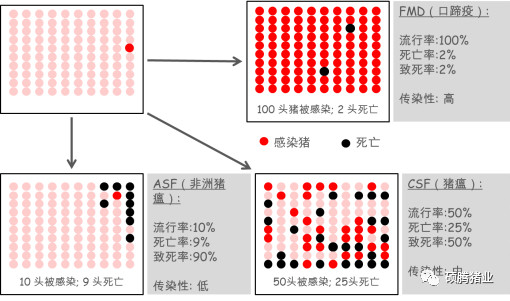
图1-3 ASF、FMD、CSF的传染性及致死率比较
04、非洲猪瘟病毒的感染及传播动力学研究
步志高等人分离鉴定了我国第一株非洲猪瘟病毒(Pig/HLJ/18),该流行毒株基于基因p72分型属于基因Ⅱ型,并运用该毒株进行了实验室的动物模型攻毒实验。研究证实,肌肉接种不同剂量的病毒(103.5~106.5 HAD50),接种后6~10天内猪只全部发病死亡,说明该毒株属于高致病性毒株。该研究发现未接种病毒的同居接触猪同样全部发病、死亡,但对于接触猪只来说,最先在口腔拭子检测到ASFV基因组(接触后6天),而血液中检测到ASFV基因组的时间要比唾液中检测到晚3天(接触后9天),肛门拭子也晚于口腔拭子(接触后10天)。此结果提示我们:自然感染ASFV的猪只,可最先在口腔拭子中检测到ASFV基因组,需要明确的是检测到ASFV基因组并不代表着这些病毒具有感染性,但却表明该猪只已感染非洲猪瘟病毒,是需要立刻进行精准剔除的对象。
Claire等进一步研究了ASFV(Georgia 2007/1株)的感染及传播动力学,该研究发现,不管是直接接触猪(与接种猪位于同一猪栏内)还是间接接触猪(位于接种猪相邻的猪栏内)都是最先在口腔拭子中检测到ASFV基因组。该结果与步志高等人的研究结果一致,推测是因为当ASFV通过接触传播时,ASFV可能会最先在位于感染部位附近的淋巴结中复制,导致我们能最先在口腔拭子或者鼻拭子中检测到ASFV基因组。同时Claire等进一步发现在口腔中无法分离到具有感染性的ASF病毒粒子,这提示我们可以通过检测口腔拭子来早期确认感染ASFV的猪只,此时感染ASFV的猪只尚未出现临床症状,更没有对外排毒,可迅速精准剔除这些处于潜伏期感染的猪只。该研究同时还发现:间接接触猪只出现病毒血症的时间(13天左右)要晚于直接接触猪只(10天左右)。Linda等发现在同一圈内ASFV传播速度(R值为2.21)比在邻圈间(R值为1.18)的传播速度快,提示我们猪栏构造可能会影响ASFV的传播,如猪圈之间的实心墙壁等可降低ASFV的传播速度。在实施精准剔除的过程中,同圈内的猪只选择直接剔除,而相邻圈内的猪只可通过检测后再决定是否剔除,这样可以减少精准剔除的数量,从而降低猪场的损失。
此外该研究还发现,ASFV的感染静默期要比ASFV的潜伏期长1~3天(图1-4),这里首先需要明确两个概念:ASFV的感染静默期指的是猪只从开始感染ASFV到该猪只具有感染其他猪只ASFV的时间(向外排放具有感染性的ASF病毒粒子);ASFV的潜伏期指的是猪只从开始感染ASFV到出现非洲猪瘟临床症状的时间,这是两个完全不同的概念。
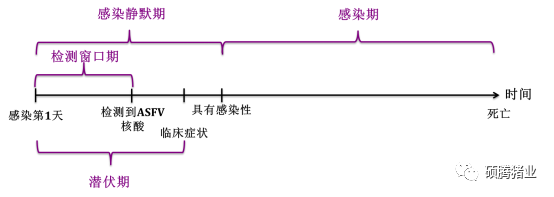
图1-4 ASFV感染静默期与ASFV潜伏期时间比较
从图1-4可以看出,ASFV的感染静默期长于潜伏期(1~3天左右),表明感染猪只即使出现ASF的临床症状,这时候该猪只可能依然不具有感染性(不对外排放具有感染性的病毒粒子)(图1-5)。
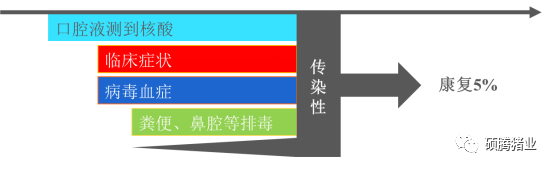
图1-5 非洲猪瘟的排毒时间示意图
综上所述,在感染猪只出现ASF临床症状之前,我们可以通过口腔拭子检测到ASFV核酸,从而在早期确定处于潜伏期感染的猪只。因此对于非洲猪瘟来说,猪场实施精准剔除的方法是存在理论依据的。
综上所述,非洲猪瘟之所以能做到精准剔除的理论基础主要有三点:
1、非洲猪瘟的传播速度非常慢,为我们清除感染猪只提供了时间;
2、非洲猪瘟的感染静默期比潜伏期长,刚刚出现临床症状的猪只并没有向外排毒,我们可以在感染猪只向外排毒前清除;
3、可以通过检测口腔拭子,在猪只出现临床症状前确认感染猪只,从而把处于潜伏期感染的猪只清除。
因此,我们认为通过实施科学的精准剔除方案,是可以在猪场内部实现非洲猪瘟的净化。
















